在有机化合物分子中,由于电负性不同的取代基(原子或原子团)的影响,使整个分子中的成键电子云密度向某一方向偏移,使分子发生极化的效应,叫诱导效应。由极性键所表现出的诱导效应称做静态诱导效应,而在化反应过程中由于外电场(如试剂、溶剂)的影响所产生的极化键所表现出的诱导效应称做动态诱导效应。诱导效应只改变键内电子云密度分布,而不改变键的本性。且与共轭效应相比,无极性交替现象。
基本性质诱导效应的特征是电子云偏移沿着σ键传递,并随着碳链的增长而减弱,最终消失。诱导效应是一种短程力,传递到第三个碳时已经很弱,传到第五个碳时几乎完全消失。诱导效应是一种静电作用,是永久性的,属于电子效应的一种。1
表示方法在诱导效应中,一般用箭头“→”表示电子移动的方向,表示电子云的分布发生了变化。例如,氯原子取代了烷烃碳上的氢原子后,如下图:
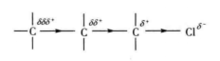
由于氯的电负性较大,吸引电子的能力较强,电子向氯偏移,使氯带部分负电荷(δ-)、碳带部分正电荷(δ+)。带部分正电荷的碳又吸引相邻碳上的电子,使其发生偏移。
类型静态诱导效应:由于分子内极性共价键的存在(内在电场)而导致的,使静态分子固有的性质。对化合物反应活性的影响具有两面性,在一定条件下可增加反应活性,也可能会降低反应活性。
动态诱导效应:是发生在化学反应时,由于外界电场的出现而发生的。通常只是在进行化学反应的瞬间才表现出来,所起的作用大都是加速反应的进行。2
诱导效应指数化学活性的定量尺度。
发展简史1923年G.N.路易斯首先提出取代基团吸引或释放电子的作用可以在整个分子中的各键上引起价电子对移动的概念。C.K.英戈尔德等将常见的基团和原子排列成一个诱导效应强弱的定性序列。
科学工作者根据化合物的物理化学性质、反应平衡常数和速率常数等方面的大量实验结果,提出了各种基团特性常数,以定量或半定量地表达基团的诱导效应强弱。其中最著名的是L.P.哈米特的取代常数 σ(见哈米特方程)和R.W.塔夫脱的极性取代常数 σ*。
1962年蒋明谦和戴萃辰认为诱导效应不仅与成键原子的电负性有关,还与键长有关,并根据原子的电负性及其共价半径,提出用诱导效应指数来定量地表示基团的诱导效应强弱。
比较标准诱导效应的大小和方向与原子或原子的电负性有关。在比较各种原子或原子团的诱导效应时,通常以C—H键中的氢原子为标准,规定Ι=0。3
吸引电子能力(电负性较大)比氢原子强的原子或原子团(如—X、—OH、—NO2、—CN等)有吸电子的诱导效应或拉电子诱导效应(-I效应),整个分子的电子云偏向取代基。吸引电子能力比氢原子弱的原子或原子团具有给电子的诱导效应或推电子诱导效应(+I效应),整个分子的电子云偏离取代基。
取代基的诱导效应强弱有如下规律:
1、同族元素中,原子序数越大,吸电子诱导效应越弱;同周期元素中,原子序数越大,吸电子诱导效应越强。
2、基团不饱和程度越大,吸电子诱导效应越强。这是由于各杂化态中s轨道成分不同而引起的,s成分越高,吸电子能力越强。
3、正电荷基团和含配位键(直接相连)的基团具吸电子诱导效应,负电荷基团具给电子诱导效应。
4、烷基具给电子诱导效应和给电子超共轭效应。
下图为一些原子或基团诱导效应大小的次序
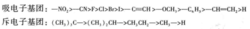 诱导效应对有机酸的酸性强弱影响很大。凡是能引起羰基碳原子上电子云密度降低的诱导效应都能使酸性增强,能引起羰基碳原子上电子云密度升高的诱导效应时酸性减弱。这种影响越大,酸性强弱的变化就越大。
诱导效应对有机酸的酸性强弱影响很大。凡是能引起羰基碳原子上电子云密度降低的诱导效应都能使酸性增强,能引起羰基碳原子上电子云密度升高的诱导效应时酸性减弱。这种影响越大,酸性强弱的变化就越大。
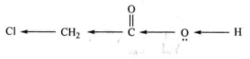
例如,氢原子取代乙酸的α-H后,生成氯乙酸,由于氯的-I效应通过碳链传递,使羰基中O—H键极性增加,氢更容易以质子形式解离下去,从而酸性增强,致使ClCH2COOH的酸性强于CH3COOH的酸性。
递降率诱导效应是一种静电诱导作用,其作用随所经距离的增大而迅速减弱。诱导效应在一个σ 键体系中传递时,一般认为每经过一个链上原子,即降低为原来的约三分之一。通常以ε或1/α来表示递降率。经过n个原子后,其诱导效应只有原来的(1+α)n。一般认为,经过三个原子后诱导作用可忽略。
相关扩展共轭效应共轭体系原指像 1,3-丁二烯这样单双键交替的体系,现在泛指能和 π 电子云侧面交盖并形成多原子轨道的体系。共轭体系产生共轭效应,用C 表示。若取代基使体系的 π 电子云密度增大,则该取代基具有给电子的共轭效应,用+C 表示;若取代基使体系的 π 电子云密度减小,则该取代基具有吸电子的共轭效应,用-C 表示。
共轭效应的强弱判断为:
1、原子电负性的影响。原子电负性越大,吸电子能力越强,从而给电子的共轭效应越弱。
2、不饱和度的影响体系的不饱和度越大,共轭体系越大,从而共轭效应也越大。
3、取代基所带电荷的影响。负电荷越多,给电子的共轭效应越强;正电荷越多,吸电子的共轭效应
越强;通常负电荷给电子的共轭效应大于中性分子。
4、原子能级差异的影响。原子能级差异越小,共轭效应越强。4
竞争关系通过对诱导效应和共轭效应的分析,总结出便于区分二者的竞争关系,如下图:

由图可见,从左边看,结果为吸电子效应,有以下几种情况:
(1)仅有诱导效应而无共轭效应.此类取代基电负性大于碳,且母体中与取代基相连的第一个碳原子饱和。
(2)取代基为给电子的共轭效应小于吸电子的诱导效应的基团(+C(CH3)2CH->CH3CH2-。
(2)取代基为能产生 р-π 共轭的除卤素外的其它端基有孤对电子的简单基团。此类取代基多为有孤对电子的基团或负离子,如氨基、烷氧基、氧负离子和碳负离子等。
(3)取代基为能产生 р-π 共轭的某些复杂基团此类取代基大多比较复杂,基团中一般包含有孤对电子的原子以及碳碳不饱和键,形成 р-π 共轭。既可能是吸电子效应也可能是给电子效应.通常为某些二价共轭体系基团。
应用一般来说:
1、体系越缺电子,酸性越强;体系越富电子,碱性越强。
2、缺电子的体系使其电子越多越稳定,给电子基团能使该体系更稳定;富电子的体系使其电子越少越稳定,吸电子基团能使该体系更稳定。
3、越稳定的物质越容易生成.反应过程中,稳定中间体的生成量最多,反应速率也最快,有些物质可能会通过重排生成更稳定的中间体;反应的最终产物以最稳定的物质为主。
举例:比较下列化合物的酸性并排序。
(A)间硝基苯甲酸;(B)对硝基苯甲酸;(C)邻硝基苯甲酸;(D)苯甲酸。
答案 :C>B>A>D
解析 :芳环羧酸的邻位异构体的酸性是最强的,原因为:
1、诱导效应。邻位取代时,羧基和硝基的距离太近,导致羧基碳氧双键上的 π 电子难以和苯环上的 π 电子较好地共轭,故以诱导为主。取代基吸引羧基上的电子云,从而增大了酸的解离;
(2)共轭效应。间位和对位的诱导效应很弱,以共轭效应为主,且间位共轭效应大于对位。共轭效应使得羰基上的电子云密度增大,对羧基的吸引力减小,故而使得所示的酸性解离减弱。4
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国