键角是指在分子中,一个原子与其他两个原子形成的两个化学键之间的夹角叫做键角。键角是反映分子空间结构的重要因素之一。从原则上说,键角可以用量子力学近似方法计算出来,但对复杂分子,但实际上键角还是通过光谱、衍射等结构实验测定的。1
键角与分子构型键角是共价键方向性的反映,与分子的形状(空间构型)有密切联系。例如,水分子中两个H—O键之间的夹角是104.5°,这就决定了水分子的角形结构。一般知道一个三原子分子中键长和键角的数值,就能确定这个分子的空间构型。二氧化碳分子中C—O键长是116pm,两个C—O键的夹角是180°,二氧化碳是直线型分子。对于4个原子以上的分子,除知道键长和键角以外,还需知道两面角,方可确定其空间构型。如甲烷分子中4个C—H键等长,每两个C—H键间的夹角都是109°28′,每两个H—C—H平面之间的两面角都是120°,甲烷是正四面体型分子。氨分子中两个N—H键间的夹角是 107°18′ ,N—H键长是101.9pm,是三角锥形分子。周期表中第VA族元素与卤素 (X) 或H所形成的AB3型化合物均为氨分子状结构,仅键长、键角大小有异。2
 周期表中,同族非金属元素的氢化物或卤化物,组成相似,分子结构相同,例如第ⅣA族元素形成的CH4、CCl4、SiH4、SiF4等,它们的分子均是正四面体结构。又如氧族的氢化物H2O、H2S、H2Se等,它们的分子均是V形结构。还有BF3、BCl3、SO3……键角120°只能是平面三角形(正三角),就是三角形顶点各有一个原子,中心原子处于三角形的重心 ,例如正六边形的每个内角都是120度,苯的结构就是正六边形。
周期表中,同族非金属元素的氢化物或卤化物,组成相似,分子结构相同,例如第ⅣA族元素形成的CH4、CCl4、SiH4、SiF4等,它们的分子均是正四面体结构。又如氧族的氢化物H2O、H2S、H2Se等,它们的分子均是V形结构。还有BF3、BCl3、SO3……键角120°只能是平面三角形(正三角),就是三角形顶点各有一个原子,中心原子处于三角形的重心 ,例如正六边形的每个内角都是120度,苯的结构就是正六边形。
键角会受分子内的结构改变的影响,如在NH3中,键角本应为109°28′,但由于N有一个独立电子对,因此压迫N原子,使键角减小,为107°18′。理论上可用量子力学近似方法算出键角,实验上是用X射线衍射法或分子光谱法精确测定键角。
影响因素键角与键长是决定分子构型的基本参数,除少数规则构型分子的键角与分子中中心原子价层中电子对的排布一致外,绝大多数分子的键角偏离标准键角。影响分子键角偏离的因素很多,但主要因素是中心原子价层中电子对的类型和成键原子的电负性。
孤对效应孤电子对与成键电子对的电子云分布不同,成键电子又受到两个成键原子核的吸引,电子云比较集中在键轴的位置,而孤电子对则只受中心原子核的吸引,在原子周围占的体积比较“肥大”。孤电子对的这种特性,使它比键对更强烈的排斥相邻电子对,导致孤电子对与相邻电子对之间平均距离大于成键电子对与同一电子对之间的平均距离。因此,对于具有相同价层电子对总数的分子或离子来说,由于互斥作用的强弱不同,若中心原子价层轨道上存在孤电子对,则诸电子对在空间的排布就要偏离标准键角。孤电子对越多,键角愈小。
重键效应分子中存在重键时,虽然 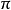 键电子不影响分子骨架,但由于重键中包含的电子数比单键中的电子数多,所占据的空间大于单键中的两个电子所占据的空间,所以排斥力强。这样多重键的存在,将进一步影响分子的键角,使得分子中含有重健的键角较大,而单键之间的键角较小。例如,X2C=O型分子,由于存在双键,双键一单键排斥大于单键—单键排斥,使键角
键电子不影响分子骨架,但由于重键中包含的电子数比单键中的电子数多,所占据的空间大于单键中的两个电子所占据的空间,所以排斥力强。这样多重键的存在,将进一步影响分子的键角,使得分子中含有重健的键角较大,而单键之间的键角较小。例如,X2C=O型分子,由于存在双键,双键一单键排斥大于单键—单键排斥,使键角




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国