亲核取代反应是指有机分子中与碳相连的某原子或基团被作为亲核试剂的某原子或基团取代的反应。在反应过程中,取代基团提供形成新键的一对电子,而被取代的基团则带着旧键的一对电子离去。
基本性质以卤代烃为例:
卤素连在饱和碳原子上,碳带有部分正电荷,卤素带有部分负电荷,富电子试剂—亲核试剂(nucleophile,简写Nu)进攻带部分正电荷的碳子,亲核试剂与碳原子形成共价键,卤原子则带着一对电子以负离子的形式离去,即卤素被亲核试剂取代,这种有机分子中的原子或基团被亲核试剂取代的反应称为亲核取代反应nucleophilicsubstitutionreaction),用SN表示,其反应通式表示如下:
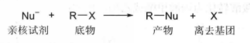
上式中卤代烷R—X为底物(substrate),常用“S”表示,Nu-为亲核试剂,X-为离去基团(leavinggroup),常用“L”表示。 与离去基团相连的碳原子称为中心碳原子。亲核试剂属于Lewis碱,可以是带负电荷的离子(如OH-、RO-、RCOO-、NO3-、NH2-、RS-、HS-、N3-、CN-、RMgX、X-等),也可以是拥有孤对电子的中性分子(如H2O、ROH、RNH2、R2NH、R3N、PPh3 等)。如果反应中所用的溶剂同时又作为亲核试剂,这样的亲核取代反应也称为溶剂解(solvolysis),如水解、醇解等。1
亲核取代反应又分为单分子亲核取代反应(SN1)与双分子亲核取代反应(SN2)。
反应类型SN1 反应第一步是原化合物的解离生成碳正离子和离去基团,然后亲核试剂与碳正离子结合。由于速控步为第一步,只涉及一种分子,故称 SN1 反应。
常发生于:碳上取代基较多,如:(CH3)3CX,使得相应碳正离子的能量更低,更加稳定。同时位阻效应也限制 SN2 机理中亲核试剂的进攻。
对碳阳离子生成有利条件:有许多释电子基团帮助稳定碳阳离子的正电荷(3级碳>2级碳>1级碳),一级碳几乎不能够单独存在,而会立刻发生化学反应而形成内能更低的分子。
反应特点:反应速率决定步骤在于离解一步(第一步),所以根据动力学理论推断该反应为一级速率反应,反应物。从立体化学观点来看,该反应的反应物若为光学异构物之一,则产物反转机率略大于50%。在碳阳离子形成时,整个分子略呈现平面三角形,亲核体可以由平面三角形上下两侧进行攻击,形成新分子。故理论上反转机率为50%,但因原先脱离的阴离子影响碳阳离子,故亲核剂倾向由反侧攻击形成反转的产物。
该反应适合在高极性稍有质子性溶剂中进行,高极性有助于利用本身极性带有的部份负电稳定碳阳离子,稍有质子性溶剂提供质子与较强亲核剂(通常是被脱离的)化合有助于反应平衡往产物移动。
SN2反应较强亲核剂直接由背面进攻碳原子,并形成不稳定的一碳五键的过渡态,随后离去基团离去,完成取代反应。
常发生于:碳原子取代较少(如:CH3X),可较容易使 SN2 反应发生。原因是碳原子上有烷基取代时会有供电效应使被进攻的碳正电性减弱,且烷基取代会产生空间位阻,阻碍进攻。
对碳正离子生成有不利条件的环境下:有许多拉电子基或较少推电子基(1级碳>2级碳>3级碳)。
**反应特点:**反应速率决定在两个因素上,强亲核剂的浓度高低与反应物的浓度高低,所以根据理论推断该反应为典型的二级速率反应。
从立体化学观点来看,该反应反应物若为光学异构物之一,则产物构型翻转机率为100%(完全反转),因为只能从反侧攻击,故产物必定反转。反应适合在高极性非质子性溶剂中进行,高极性有助于稳定反应中间体,非质子性溶剂则不会与强亲核剂化合而导致反应平衡往反应物移动。2
影响因素1、底物的烃基结构:反应底物的分子烃基中C上的支链越多,SN2的反应越慢。通常,伯碳上最容易发生SN2,仲碳其次,叔碳最难。
2、离去基团(L)一般来说,离去基团越容易离去,SN2越快。
3、亲核试剂(Nu):亲核试剂的亲核性愈强,浓度愈高,反应速度愈快。
4、溶剂的种类:极性溶剂中,SN1反应容易发生。对SN2反应不利。非极性溶剂则相反。碳正离子在极性溶剂中比在非极性溶剂中稳定。SN2的中间体电荷分散,在非极性溶剂中更稳定。
举例以卤代烃为例,发生的亲核取代反应:
1、与氢氧根负离子的反应
卤代烷与水的反应一般很慢或难以发生,但在碱性条件下卤原子可被OH取代生成醇,这个反应被称为卤代烷的水解(hydrolysis)。

通常不用卤代烷的水解反应来制备醇,因为自然界醇是大量存在的,而卤代烷是由醇制的。但对于某些复杂分子引入羟基要比引入卤素困难,这时可以先引入卤素,然后通过水解引入羟基。在天然产物合成中经常采用这种策略。
2、与硝酸银的反应
卤代烷在醇溶剂中与硝酸银作用生成硝酸酯和卤化银沉淀。在这个亲核取代反应中,硝酸根负离子中的带负电荷的氧原子亲核进攻与卤原子相连的碳,卤负离子离去,并生成卤化银沉淀。
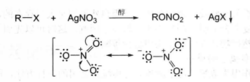
烃基相同而卤素不同的卤代烷发生这一反应的活性顺序为:RI>RBr>RCI。当卤原子相
同,烃基结构不同时,其活性顺序为:R3CX>R2CHX>RCH2X>CH3X。反应过程中生成了卤化银沉淀,有明显的现象,所以该反应曾被用于鉴别卤代烃与其他类型的有机化合物。
由于烃基结构不同的卤代烃与AgNO3/C2H5OH作用时,叔卤代烃的反应速度最快,最先生成沉淀,其次是仲卤代烃,反应最慢的是伯卤代烃,通常要加热才能产生沉淀。烯丙型和苄基型卤代烃非常活泼,与硝酸银的醇溶液能立即反应产生沉淀。而卤素直接连在双键碳原子或苯环上的卤代烃则不发生该反应。一个碳原子上连有两个或多个卤素的多卤代烃也不发生该反应。因此,根据反应条件、沉淀的颜色以及出现沉淀的时间不同,该反应可用于鉴别结构不同的卤代烃。
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国