克莱门森还原反应(Clemmensen 还原反应)是在盐酸溶液中,用锌汞齐将醛或酮中的羰基还原为亚甲基的反应,尤其是与芳香环共轭的酮能被还原。非水溶液的条件下,用氯化氢的醚溶液,甚至能还原非共轭的羰基。这种情况只需要用金属锌就可以,不需要用到毒性高的汞合金。甚至不需要金属的情况下,用电解条件也能促使反应发生。本反应在酸性条件下进行,而与之相对应的有碱性环境下的沃尔夫-凯西纳-黄鸣龙还原反应,以及中性条件下的雷尼镍脱硫还原反应。此法对于还原芳香酮效果较好,与傅氏酰基化反应相配合是合成烷基芳烃的重要方法。
基本性质克莱门森还原反应是在浓盐酸回流下,用锌汞齐将醛或酮中的羰基还原为亚甲基的化学反应。此反应操作简便,收率很高,以及多数羰基化合物在反应的酸性条件下不会引起严重的副反应,因而应用广泛。反应方程式如下:
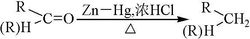
为增加反应物在浓盐酸中的浓度,往往添加一些酒精或者醋酸;另外还加入一定量的与水不相容的惰性溶剂,如甲苯,使生成的还原产物及时地由反应体系转移到惰性溶剂中,以促进反应的进行。主要用于酮的还原,用于醛的实例较少。该反应必须在强酸性条件下进行。对酸敏感的羰基化合物不可使用该方法还原,但可考虑采用黄鸣龙还原法。α、β-不饱和醛酮还原时,碳碳双键一起被还原。除α、β-不饱和键外,一般对碳碳双键无影响。1
反应机理锌汞齐(Zn-Hg)用锌粒与汞盐在稀盐酸溶液中反应制得,锌可以把Hg2+还原成Hg,然后Hg与锌在锌的表面上形成锌汞齐。反应是被活化了的锌的表面上进行的。
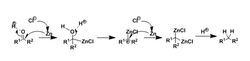
克莱门森还原是一个典型的溶金属还原,利用还原性金属在溶液中缓慢释放出的电子还原有机化合物。如果体系中没有可供还原的有机化合物,那么电子的受体将只能是质子,也就是最平常的氢气制备反应。如果有有机化合物的存在,例如苯乙酮,两个电子先后进入羰基的反键轨道,将双键还原,与此同时电子的进入使得分子带上负电,导致质子的进攻,这一步生成醇。生成的醇在强酸性条件下质子化并失去一分子水,形成活性很强的碳正离子,而碳正离子进一步被两个电子还原,先形成不带电的自由基,然后生成带负电的碳负离子,碳负离子和体系中的质子结合,生成还原产物。
以上是一种可能的机理,克莱门森还原的真实机理迄今尚未完全研究清楚。可以确认的一点是,这种还原方式条件剧烈,生成很多中间体活性很高,因此对复杂的反应原料不是很适用,而对苯乙酮这种没什么干扰基团的反应物比较方便。
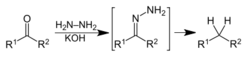
相关扩展1、沃尔夫-凯西纳-黄鸣龙还原反应(碱性条件)
是将酮羰基还原为亚甲基的还原反应,该反应常压下即可完成,反应时先将反应物与氢氧化钠、肼和高沸点醇的水溶液混合加热,生成腙后,将水和过量肼蒸出,待温度达到195~200℃时回流3~4小时后完成。
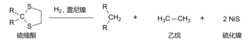
2、雷尼镍脱硫还原反应(中性条件)
雷尼镍将充当试剂参与有机含硫化合物如硫缩酮的脱硫生成烃类的反应,从而实现了从羰基间接还原为亚甲基的途径。
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国