自发过程(英语:spontaneous process),或自发程序,是系统随时间释放自由能、移往自由能更低且更加热力学平衡的能量状态的过程。自由能变化的正负值取决于热力学的测量传统,当系统释放自由能,系统自由能变化为负值,而外界自由能变化为正值。随着过程的条件不同,所采用的自由能也不相同。一般而言,过程的自发性只决定该过程是否“能够”自发,但并不代表该过程“将会”发生。换句话说,自发性是必须的,但并不足以使过程发生。此外,自发性也无法决定该过程之速率快慢。比如说,于室温常压下,钻石转化成石墨是一个自发的过程。尽管如此,这个自发过程却是极缓慢的。
基本性质自然界中发生的变化是白发进行的。例如铁在潮湿的空气中生锈,冰在常温下融化等。这种在一定条件下不需要外力作用就能进行的过程叫做自发过程。
1、自发过程均具有方向性。自发过程都只能向着与热力系统外界趋于平衡的方向进行。非自发过程的进行都必须以补偿过程的发生为条件。
2、自发过程均是不可逆过程。热力系统经过一个自发过程后,若要使其反向进行回复到初始状态,则必须提供补偿条件,这样在外界必将留下不可逆的变化。
3、 各种不可逆过程具有等效性。各种不可逆因素不是彼此独立无关的,而都是相互关联的。一个不可逆过程发生后,会留下某种不可逆变化,要使它恢复到原来的初始状态,就必然引起第二个不可逆过程的发生,势必产生另一个不可逆变化,要使第二个不可逆过程恢复到原来的初始状态,就不可避免的引起第三个不可逆过程的发生,依此类推下去,最后必然有一个不可逆变化遗留下来。因此一切不可逆过程都可以相互代替,这正说明了一切不可逆过程在本质上是一样的,等效的。
举例1、在一个箱子里,中间用隔板隔开,设法使两边的气体压力不等。将隔板去掉后,压力大的一方气体将自动地向压力小的一方流动,直到两边的压力相等。在这个过程中,人们可以用它做功,如做膨胀功,压力相等后,要想使它恢复到原来的状态,即一方压力大,另一方压力小,除非人们对它做功,如用压缩机将气体从一方压缩到另一方去,否则是不可能自动复原的。
2、两个温度不同的物体接触,热就会自动地从高温物体传向低温物体,直至温度相等为止。人们可以利用温度不等做功。温度相等后,要想使两物体的温度再恢复到一高一低的原来状态,必须对它做功,如用制冷机等,否则是不可能自动复原的。
3、将两个电势不同的电极组成电池,电流就从高电势自动地流向低电势,直至电势相等。人们可以用电流做功,如照明、加热等二电流不会自动地从低电势流向高电势,除非人们对它做功,如用发电机充电,1
由自由能决定自发性过程为恒温恒压时,能以吉布斯自由能决定其自发性,其数学式如下:
ΔG=ΔH-TΔS
由上式可知,吉布斯自由能(G)变化量之正负取决于焓(H)、熵(S)之变化量以及绝对温度(T)之大小。当绝对温度之值等于焓变化量对熵变化量之比值时,吉布斯自由能之变化量为零。
当过程之吉布斯自由能变化量为:
负值,该正向过程为自发。
正值,该正向过程为非自发,但反向过程为自发。
零,该过程处于热力学平衡,系统随时间无净变化。
借由上式,讨论焓变化量与熵变化量对吉布斯自由能变化量之影响,分为四种情况:
当熵变化量大于零,且焓变化量小于零,过程必然自发。
当熵变化量小于零,且焓变化量大于零,过程必然不自发,但逆过程必然自发。
当熵变化量大于零,且焓变化量大于零,过程于高温状态下自发、低温状态下不自发。
当熵变化量小于零,且焓变化量小于零,过程于低温状态下自发、高温状态下不自发。
于后两个情况下,可由焓变化量对熵变化量之比值大小,决定该过程之温度为高温或低温。2
由熵决定自发性当利用熵变化量作为判断过程自发性之函数时,需要特别留意系统与外界的定义。由热力学第二定律,当孤立系统之熵值随时间而增加,则该过程为自发。然而,当考虑之系统为开放或封闭时,总熵(包含系统熵与外界熵)需随时间增加。其数学式应表示为:3
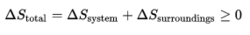
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国