氢氧化物是指金属阳离子或铵根离子与氢氧原子团(—OH)形成的无机化合物,也叫作碱,是金属元素(包括铵)的氢氧化物。可用通式M(OH)n表示。
对于非金属氢氧化物,一般不称其为氢氧化物,但一水合氨(又称氢氧化铵(NH3·H2O)例外,它的水溶液呈弱碱性。1
分类易溶于水的氢氧化物通常情况下,易溶的碱金属、碱土金属氢氧化物多数为强碱,如氢氧化钠NaOH、氢氧化钾KOH、氢氧化钡 、氢氧化锂LiOH、氢氧化锶
、氢氧化锂LiOH、氢氧化锶 等,但也有例外,如一水合氨
等,但也有例外,如一水合氨 也易溶于水,但因为其在水中的电离常数相当低,故认为其是弱碱。2
也易溶于水,但因为其在水中的电离常数相当低,故认为其是弱碱。2
微溶于水的氢氧化物通常情况下,微溶的氢氧化物一般是中强碱,如氢氧化钙 。难溶于水的氢氧化物
。难溶于水的氢氧化物
通常情况下,难溶的金属氢氧化物为弱碱,如氢氧化铁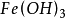 、氢氧化亚铁
、氢氧化亚铁 、氢氧化锌
、氢氧化锌 、氢氧化镁
、氢氧化镁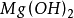 、氢氧化钴
、氢氧化钴 、氢氧化金
、氢氧化金 ,还有稀土金属氢氧化物。
,还有稀土金属氢氧化物。
两性氢氧化物 也有一些金属元素的氢氧化物呈两性,它们既能与酸反应生成盐和水,又能与碱反应生成相应的盐,这样的氢氧化物称两性氢氧化物,如氢氧化铝
也有一些金属元素的氢氧化物呈两性,它们既能与酸反应生成盐和水,又能与碱反应生成相应的盐,这样的氢氧化物称两性氢氧化物,如氢氧化铝 ,氢氧化铜
,氢氧化铜 、氢氧化铍
、氢氧化铍 等。化学性质
等。化学性质
氢氧化物具有碱的特性。能与酸生成盐和水。可溶性氢氧化物与可溶的盐进行复分解反应。难溶于水或微溶于水的氢氧化物受热分解为相应的氧化物和水。一般碱金属氢氧化物强热或灼热分解。活性较弱的金属氢氧化物微微加热即分解,如氢氧化铁。很不活泼的金属氢氧化物在低温时就可分解,如氢氧化汞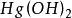 和氢氧化银AgOH。
和氢氧化银AgOH。
氢氧化物普遍呈碱性,但碱性的强弱不同,这取决于与氢氧根结合的金属阳离子对应元素的电负性,电负性越小,则其氢氧化物越容易在溶液中释放出氢氧根,碱性越强。反之,电负性越大,则其氢氧化物越容易在溶液中越释放不出氢氧根,碱性越弱。3
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国