亲核试剂(nucleophile,意思为原子核的喜好物), 又叫亲核基,指具有亲核性的化学试剂,可用:Nu表示。一些带有未共享电子对的分子或负离子,与正电性碳反应时称为亲核试剂。所谓亲核试剂就是一种电子对供体,即路易斯碱。在反应过程中,它倾向于与电正性物种结合,因为原子核是电正性的,所以“亲核”即是指亲“电正性”。
基本性质在极性反应中,亲核试剂提供能量较高的电子对,用于形成新键。亲核试剂的电子对可以是亲核原子上的未共用电子对或负电荷,也可来自于试剂分子中σ键或π键的异裂。根据亲核试剂如何提供电子对,将亲核试剂分成三种类型:未共用电子对型亲核试剂(lone—pair nucleophiles),σ键型亲核试剂(σ一bond nucleophiles)和π键型亲核试剂(π一bond nucleophiles)。
未共用电子对型亲核试剂的亲核原子上有未共用的电子对,可用于与亲电试剂的亲电原子形成新键。
例如,以下亲核反应中,胺作为未共用电子对型亲核试剂提供电子,与亲电试剂成键:
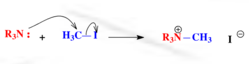
除胺外,常见的未共用电子对型亲核试剂还有醇、硫醇、烷氧负离子、碳负离子等。

σ键型亲核试剂当非金属原子与金属原子之间形成共价键时,由于非金属原子的电负性通常较大,使得非金属原子带部分负电荷,金属原子带部分正电荷。在极性反应中,这类化合物分子中非金属原子与金属原子之间的共价键可以异裂,非金属原子作为亲核原子带着成键电子对参与反应,因此称这类亲核试剂为σ键型亲核试剂。1
例如,氢化铝锂与羰基化合物反应时,氢化铝锂分子中的Al—H键发生异裂,氢带着成键电子与羰基碳发生亲核加成。
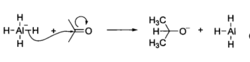
σ键型亲核试剂的亲核原子可以是杂原子(如NaNH2或KOH),也可以是碳原子(如RMgBr、RLi和R2CuLi)或氢原子(如NaBH4和LiAIH4)。但是,强极性的非金属一金属键Nu—M常被认为是离子键(Nu-M+)。例如下图所示的几种试剂通常写成离子键的形式:
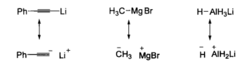
按这样的写法,这类试剂也可分类为未共用电子对型亲核试剂。
π键亲核试剂利用π键的成键电子对与亲电试剂的亲电原子形成σ键。例如,烯烃的π键在反应中可以发生异裂,其中的一个双键碳原子带着成键电子对与亲电试剂反应。因此,富电子烯烃是亲核试剂。
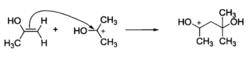
亲核试剂烯烃与亲电试剂反应时,总是电子云密度高的双键碳与亲电试剂形成新键。对于纯烷基取代的烯烃,取代较少的碳亲核性强,优先与亲电试剂结合。
与碱性关系由于亲核试剂在反应中提供电子,按照Lewis酸碱理论,提供电子的为碱,因此,亲核试剂通常呈碱性。许多亲核反应在碱性条件下进行,了解亲核性与碱性的关系很重要。亲核试剂的亲核性强弱通常用其与亲电试剂反生的速率来衡量。
例如,根据其在25℃的水溶液中与CH3Br发生亲核取代反应的速率来衡量。因此,亲核性是动力学性质。试剂的碱性是其与H+反应的能力(用平衡常数的负对数表示),是热力学性质。试剂的亲核性与碱性有联系,也有区别。2
影响因素试剂的亲核性和碱性的强弱与亲核原子周围的空间位阻、电荷离域、反应介质等因素均有关系。
1、亲核原子周围立体位阻增加,亲核性显著降低,碱性则变化不大。
例如,EtO-是强碱(pKb=17)和强亲核试剂,而t-BuO-的亲核性则非常小,但碱性却略有增加(pKb=19)。这类强碱弱亲核试剂有时也称为非亲核碱,在亲核反应中作为碱催化剂被广泛应用。
2、电荷离域使碱性显著降低,对亲核性影响则较小。例如,EtO-(pKb=17)在较低温度下与s-BuBr反应,起碱的作用,生成消除产物2—丁烯;而AcO-(pKb=4.7)在较高的温度下能作为亲核试剂与s-BuBr发生SN2反应生成s-BuOAc。
3、反应介质对试剂的亲核性也有重要影响,特别是极性非质子溶剂可以显著增加试剂的亲核性,常作为亲核反应的溶剂。常用的极性非质子溶剂如图:
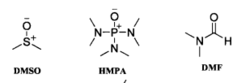
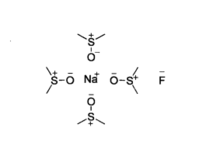
这些极性非质子溶剂通常具有亚砜、酰胺或磷酰胺的结构,由于共振,处于分子外围的氧通常带部分负电荷,而处于分子内部的硫、磷或碳则带部分正电荷。氟化钠等亲核试剂在这种溶剂中其正离子会被深度溶剂化,使负离子脱离正离子的束缚,亲核性显著增加。
本词条内容贡献者为:
代祥光 - 副教授 - 西南大学电子信息工程学院




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国