价键理论成功地解释了共价键的本质和特性,可以说明一些简单分子的内部结构,但 在阐明多原子分子的几何构型时遇到困难。为了解释多原子分子的几何构型,鲍林(L.Pauling)和斯 莱特(J.C.Slater)在1931年提出了杂化轨道理论。杂化轨道理论是一种科学理论。在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫做杂化轨道。
基本介绍杂化轨道理论(hybrid orbital theory)是1931年由莱纳斯·鲍林(Pauling L)等人在价键理论的基础上提出的。虽然它实质上仍属于现代价键理论,但是它在成键能力、分子的空间构型等方面丰富和发展了现代价键理论。
核外电子在一般状态下总是处于一种较为稳定的状态,即基态。而在某些外加作用下,电子也是可以吸收能量变为一个较活跃的状态,即激发态。在形成分子的过程中,由于原子间的相互影响,单个原子中,具有能量相近的两个能级中,具有能量较低的能级的一个或多个电子会激发而变为激发态,进入能量较高的能级中去,即所谓的跃迁现象,从而新形成了一个或多个能量较高的能级。此时,这一个或多个原来处于较低能量的能级的电子所具有的能量增加到与原来能量较高的能级中的电子相同。这样,这些电子的轨道便混杂在一起,这便是杂化,而这些电子的状态也就是所谓的杂化态。
用化学语言讲,杂化轨道理论从电子具有波动性、波可以叠加的观点出发,认为一个原子和其他原子形成分子时,中心原子所用的电子轨道不是原来纯粹的s轨道或p轨道,而是若干不同类型、能量相近的电子轨道经叠加混杂、重新分配轨道的能量和调整空间伸展方向组成的同等数目的能量完全相同的新的电子轨道——杂化轨道,以满足化学结合的需要。这一过程称为电子轨道的杂化。1
基本要点1、 某原子在成键时,在键合原子的作用下,同一原子中不同类型能量相近的原子轨道可能改变原有的状态,混杂起来并重新组合成一组有利于成键的新轨道(即杂化轨道)。 这一过程称为原子轨道的杂化,简称杂化。
2 、同一原子中能量相近的n 个原子轨道,组合后只能得到n个杂化轨道。例如,同一 原子的一个n s 轨道和一个npx轨道,只能杂化成两个sp杂化轨道。这两 个s p 杂化轨道的形状一样,但其角度分 布最大值在x轴上的取向相反。
3 、杂化轨道比原来未杂化的轨道成键能力强,形 成的化学键键能大,使生成的分子更稳定。 由于成键原子轨道杂化后,轨道角度分布图的形 状发生了变化,形成的杂化轨道一头大一头小。大的 一头与别的原子成键时电子云可以得到更大程度的重 叠 ,所以形成的化学键比较牢固。2
理论说明(1)s-p型杂化
只有s轨道和p轨道参与的杂化,主要有以下三种类型:sp1杂化,sp2杂化 ,sp3杂化。
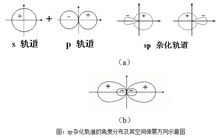
(2)s-p-d型杂化
ns轨道,np轨道,nd轨道一起参与杂化称为s-p-d型杂化,主要有以下几种类型:
sp3d杂化:由一个ns、三个np轨道和一个nd轨道杂化形成五个能量等同的sp3d杂化轨道。每个sp3d轨道都含有1/5个s、3/5个p和1/5个d成分。构型为三角双锥。 sp3d2杂化:由一个ns、三个np轨道和二个nd轨道杂化形成六个能量等同的sp3d2杂化轨道。每个sp3d2轨道都含有1/6个s、1/2个p和1/3个d成分。构型为八面体。
此外还有以内层的(n-1)d轨道,ns轨道,np轨道一起参与的杂化方式,它主要存在于过渡金属配位化合物中,例如d3sp3杂化、d2sp3杂化等。
(3)等性杂化和不等性杂化
杂化过程中形成杂化轨道可能是一组能量的并轨道,也可能是一组能量彼此不相等的轨道。因此,轨道的杂化方式可分为等性杂化和不等性杂化。1
空间形态几种杂化轨道之后的分子空间形态
sp杂化:直线形 如:CO2、CS2、BeCl2、HgCl2、C2H2
sp2杂化:平面三角形(等性杂化为平面正三角形) 如:BCl3;正六边形 如:石墨
sp3杂化:空间四面体(等性杂化为正四面体) 如:CH4、CCl4
sp3d杂化:三角双锥 如:PCl5
sp3d2杂化:八面体(等性杂化为正八面体)如SF6
sp3d3杂化:五角双锥 如:IF7
dsp2杂化:平面四方形(等性杂化为正方形) 如:Pt(NH3)2Cl2(顺铂)
注: 中心原子有孤对电子的还要视孤对电子对数而定具体的空间结构 如:H2O V形(角形)1
相关种类轨道杂化一般发生在s轨道与p轨道之间,简称为sp型杂化。这类杂化轨道种类很多。可分为sp1;、sp2;、sp3;三种。
如三氯化硼(BCl3)分子中B有sp2杂化轨道,即由1个s轨道和2个p轨道组合成3个sp2杂化轨道,在氯化铍(BeCl2)中有sp杂化轨道,在过渡金属化合物中还有d轨道参与的sp3d和sp3d2杂化轨道等。以上几例都是阐明了共价单键的性质,至于乙烯和乙炔分子中的双键和三键的形成,又提出了σ键和π键的概念。如把两个成键原子核间联线叫键轴,把原子轨道沿键轴方向“头碰头”的方式重叠成键,称为σ键。把原子轨道沿键轴方向“肩并肩”的方式重叠,称为π键。例如在乙烯(CH2= CH2)分子中有碳碳双键(C=C),碳原子的激发态中2px,2py和2s形成sp2杂化轨道,这3个轨道能量相等,位于同一平面并互成120℃夹角,另外一个pz轨道未参与杂化,位于与平面垂直的方向上。碳碳双键中的sp2杂化如下所示。
这3个sp2杂化轨道中有2个轨道分别与2个H原子形成σ单键,还有1个sp2轨道则与另一个C的sp2轨道形成头对头的σ键,同时位于垂直方向的pz轨道则以肩并肩的方式形成了π键。也就是说碳碳双键是由一个σ键和一个π键组成,即双键中两个键是不等同的。π键原子轨道的重叠程度小于σ键,π键不稳定,容易断裂,所以含有双键的烯烃很容易发生加成反应,如乙烯(H2C=CH2)和氯(Cl2)反应生成氯乙烷(Cl—CH2—CH2—Cl)。
乙炔分子(C2H2)中有碳碳叁键(HC≡CH),激发态的C原子中2s和2px轨道形成sp杂化轨道。这两个能量相等的sp杂化轨道在同一直线上,其中之一与H原子形成σ单键,另外一个sp杂化轨道形成C原子之间的σ键,而未参与杂化的py与pz则垂直于x轴并互相垂直,它们以肩并肩的方式与另一个C的py,pz形成π键。即碳碳三键是由一个σ键和两个π键组成。这两个π键不同于σ键,轨道重叠也较少并不稳定,因而容易断开,所以含三键的炔烃也容易发生加成反应。2
举例说明以CH4分子的形成为例。
基态C原子的外层电子构型为2s22px12py1。在与H原子结合时,2s上的一个电子被激发到2pz轨道上,C原子以激发态2s12px12py12pz1参与化学结合。当然,电子从2s激发到2p上需要能量,但由于可多生成二个共价键,放出更多的能量而得到补偿。
在成键之前,激发态C原子的四个单电子分占的轨道2s、2px、2py、2pz会互相“混杂”,线性组合成四个新的完全等价的杂化轨道。此杂化轨道由一个s轨道和三个p轨道杂化而成,故称为sp3杂化轨道。经杂化后的轨道一头大,一头小,其方向指向正四面体的四个顶角,能量不同于原来的原子轨道。
形成的四个sp3杂化轨道与四个H原子的1s原子轨道重叠,形成(sp3-s)σ键,生成CH4分子。
由于杂化轨道的电子云分布更为集中,杂化轨道的成键能力比未杂化的各原子轨道的成键能力强,故形成CH4分子后体系能量降低,分子的稳定性增强。1
本词条内容贡献者为:
李廉 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国