浓度是溶液中溶剂和溶质的相对含量。物质的量浓度是一种常用的溶液浓度的表示方法。
定义物质的量浓度(amount of substance concentration)定义为溶液中溶质B的物质的量除以混合物的体积,简称浓度,用符号c(B)表示,即:
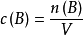

式中,Cb代表溶质的物质的量浓度,n代表溶质的物质的量,V代表溶液的体积,如果没有做特别说明的话,那么认为:溶剂为水。物质的量的SI单位为mol·m⁻³,常用单位为mol·dm⁻³或mol·L⁻¹。1
注意物质的量浓度公式中的体积是指溶液的体积,而不是溶剂的体积。
在一定物质的量浓度溶液中取出任意体积的溶液,其浓度不变,但所含溶质的物质的量或质量因体积的不同而不同。
溶质的量是用物质的量来表示的,不能用物质的质量来表示。
例如:配制1mol/L的氯化钠溶液时,氯化钠的式量为23+35.5=58.5,故称取58.5g氯化钠,加水溶解,定容至1000ml即可获得1mol/L的氯化钠溶液。
溶质可以是单质、化合物,也可以是离子或分子等其他特定组合,如 c(NaCl)。
非电解质在其水溶液中以分子形式存在,溶液中溶质微粒的浓度即为溶质分子的浓度。如 1mol/L乙醇溶液中,乙醇分子的物质的量浓度为1mol/L。
强酸、强碱、可溶性盐等强电解质在其水溶液中以阴离子和阳离子形式存在,各种微粒的浓度要根据溶液的浓度和溶质的电离方程式来确定。
换算1.二者都表示溶液的组成,可以通过一定关系进行相互换算。
将溶质的质量分数换算成物质的量浓度时,首先要计算1L溶液中含溶质的质量,换算成相应物质的量,有时还需将溶液的质量换算成溶液的体积,最后才换算成溶质的物质的量浓度。
将溶质的物质的量浓度换算成溶质的质量分数时,首先要将溶质的物质的量换算成溶质的质量,有时还将溶液的体积换算成质量,然后换算成溶质的质量分数。
n=m/M=V·ρ·ω/M,c=n/V
c= (V·ρ·ω/M)/V= V·ρ·ω/MV=1000ρ·ω/M(倒数第二步,ρ(密度)的单位是克每立方厘米,乘以1000换成与物质的量浓度同样的单位,即克每升)
饱和溶液的溶解度S和物质的量换算,得: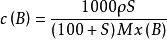
质量摩尔浓度bB换算成物质的量浓度cB: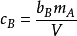
2.不同物质的量浓度溶液的混合计算
物质的量浓度相近时,可以近似看成混合后溶液体积不变。
混合后溶液体积不变时 C1V1+C2V2=C3 (V1+V2)
混合后溶液体积改变时 C1V1+C2V2=C3V32
应用世界卫生组织提议,凡是已知相对分子质量的物质在体液内的含量均应用物质的量浓度表示。物质的量浓度在医学上已逐渐推广使用。例如人体血液中葡萄糖含量的正常值,按法定计置单位应表示为c(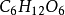 )=3.9 ~5.6 mmol/L。对于未知摩尔质量的物质可用质量浓度表示。对于注射液,世界卫生组织认为,在绝大多数情况下,应同时标明质量浓度和物质的量浓度。例如,临床上输液用的等渗葡萄糖溶液,过去常标为5%, 现应标为 50 g/L
)=3.9 ~5.6 mmol/L。对于未知摩尔质量的物质可用质量浓度表示。对于注射液,世界卫生组织认为,在绝大多数情况下,应同时标明质量浓度和物质的量浓度。例如,临床上输液用的等渗葡萄糖溶液,过去常标为5%, 现应标为 50 g/L 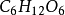 和0.28 mol/L
和0.28 mol/L  。1
。1
配置溶液实验仪器除试剂外,配制中必须用到的实验仪器有:容量瓶、烧杯、玻璃棒、胶头滴管,用固体配制还需用到托盘天平和药匙、(或烧杯),用液体配制还需用量筒(或滴定管、移液管)等等。
配制步骤⑴计算:计算配制所需固体溶质的质量或液体浓溶液的体积。
⑵称量:用托盘天平称量固体质量或用量筒(应用移液管,但中学阶段一般用量筒)量取液体体积。
⑶溶解:在烧杯中溶解或稀释溶质,冷却至室温(如不能完全溶解可适当加热)。
⑷转移:将烧杯内冷却后的溶液沿玻璃棒小心转入一定体积的容量瓶中(玻璃棒下端应靠在容量瓶刻度线以下)。
⑸洗涤:用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转入容器中,振荡,使溶液混合均匀。
⑹定容:向容量瓶中加水至刻度线以下1cm~2cm处时,改用胶头滴管加水,使溶液凹面恰好与刻度线相切。
⑺摇匀:盖好瓶塞,用食指顶住瓶塞,另一只手的手指托住瓶底,反复上下颠倒,使溶液混合均匀。
⑻装瓶贴签:最后将配制好的溶液倒入试剂瓶中,贴好标签。
注意事项⑴只能配制容量瓶上规定容积的溶液。
⑵ 转移溶液时玻璃棒要靠在刻度线以下。
⑶如果加水定容超过了刻度线,不能将超出部分吸走,而应重新配制。
⑷用胶头滴管定容时,眼睛应平视液面。
⑸摇匀后若出现液面低于刻度线的情况,不能再加水。1
误差分析
|| ||
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国