表面活性剂溶于非极性的有机溶剂中,当其浓度超过临界胶束浓度(CMC)时,在有机溶剂内形成的胶束叫反胶束 (reversed micelle),或称反相胶束。 在反胶束中,表面活性剂的非极性基团在外与非极性的有机溶剂接触,而极性基团则排列在内形成一个极性核(polar core)。此极性核具有溶解极性物质的能力,极性核溶解水后,就形成了“水池”(water pool)。反胶束是一种自发形成的纳米尺度的聚集体,是一种透明的、热力学稳定的W/O体系。
反胶束萃取技术具备萃取速度快、成本较低、条件要求不高以及不会引起活性物质失去活性等优越性,越来越受到重视,已经广泛应用于蛋白质、酶等生物活性大分子的分离提纯,显示出了较好的应用前景。
反胶束体系的概念及相关知识当表面活性剂在水中的浓度超过了临界胶束浓度(CMC)时,会形成一种非极性核心的微胶团结构,即亲水基团朝向水相,而多个表面活性剂分子(或离子)的疏水基团相互缔合,称为正常胶束(O/W型胶团);如果表面活性剂浓度超过临界胶束浓度(CMC)且溶于非极性有机溶剂时,此时极性和非极性基团会定向排列形成与上述相反的聚集体,即反胶束(W/O型胶团);
反胶束(reversedmicelles)是分散于连续有机相中的表面活性剂会自发形成具有纳米尺度的团聚体(聚集体0。在这种团聚体即反胶束中的表面活性剂上的疏水基和亲水基则分别向外和具有非极性的有机相发生接触,朝内聚集形成一个极性核(polarcore)。极性核可以容纳(或增溶)少量水,称为“水池”(waterpool)。通常,正辛烷、异辛烷、正辛醇等有机溶剂用以形成反胶束体系的有机相;而表面活性剂则根据其极性基团性质的不同可分为三种类型,即阳离子型、阴离子型以及非离子型。在以上三种类型中非离子型表面活性剂与其他两种相比属于不太常见的类型。常见的阳离子型表面活性剂为CTAB、TOMAC、AOT等。反胶束的形成与表面活性剂及其溶剂的种类、浓度及操作温度等因素有关,一般为非离子表面活性剂大于阳离子表面活性剂,而阳离子表面活性剂则大于阴离子表面活性剂。1
反胶束体系的性质反胶束体系的性质常用参数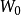 、Ф与N来表示,其中
、Ф与N来表示,其中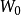 表示形成反胶束微粒水的摩尔浓度与表面活性剂的摩尔浓度之间的比值,其在一定程度上反映了反胶束的大小,是一个能够表征反胶束体系增溶能力的重要指标。一般随着
表示形成反胶束微粒水的摩尔浓度与表面活性剂的摩尔浓度之间的比值,其在一定程度上反映了反胶束的大小,是一个能够表征反胶束体系增溶能力的重要指标。一般随着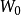 的增加,反胶束的半径也随之增大,从而增大了萃取率。Ф(mol/L)是增溶水相对于有机相总体积的浓度。N是反胶束的聚集数。1
的增加,反胶束的半径也随之增大,从而增大了萃取率。Ф(mol/L)是增溶水相对于有机相总体积的浓度。N是反胶束的聚集数。1
反胶束体系的制备方法注入法:将含蛋白质的水溶液直接注入到含表面活性剂的非极性有机溶剂中,然后进行搅拌直M形成透明溶液为止,过程较快、可控制平均直径和含水量。
相转移法:将含蛋白质的水相和含表面活性剂的夼机相接触,在缓慢搅拌下,一部分蛋H 质转移至有机相中。 过程较慢,处于稳定的热力学平衡状态和获得较高的蛋白质浓度。
溶解法:对非水溶性的蛋白质可用此法。将含有反胶束的有机溶液与蛋白质固体粉末一起搅拌时,蛋白质进入反胶朿中,需较长的时间。1
反胶束体系形成影响因素一般认为,蛋白质在反胶束中的溶解作用,与蛋白质的表面电荷同反胶束的内表面电荷间的静电作用以及反胶朿的大小有关.所以,任何可以增强这种静电作用或导致形成较大反胶束的因素,均有助于蛋白质在反胶朿中的溶解。实验表明 ,影响反胶朿形成的因素有表面活性剂的种类和浓度,体系中水分的含量,水相的酸碱度,水相的离子强度以及蛋白质。1
重要的应用-反胶束萃取体系产生背景传统萃取方法(如溶剂萃取)难应用于蛋白质的分离,原因:1. 大多数蛋白质都不溶于有机溶剂,与有机溶剂接触,也会引起蛋白质的变性;2. 萃取剂问题,蛋白质分子表面带有许多电荷,普通的离子缔合型萃取剂很难起作用。
反胶束萃取体系的种类单一反胶束萃取体系:
阴离子型:AOT(丁二酸-2-乙基己基酯磺酸钠)/ 异辛烷
阳离子型:十六烷基三甲基溴化铵,二辛基二甲基氯化铵
非离子型
混合反胶束体系:两种或两种以上的表面活性剂组成,萃取效率更高1
反胶束萃取蛋白质的原理和影响因素1 原理
反胶束萃取蛋白质的原理利用反胶束进行蛋白质萃取的过程是一个协同过程,通常包括萃取和反萃取过程。反胶束溶液是透明的,属于热力学稳定体系,它包括含有极少量表面活性剂和有机溶剂的水相和有机溶剂连续相。萃取时,待萃取的蛋白质溶液以水相形式与反胶束微粒接触,使蛋白质分子先以最大限度转入反胶束微粒(萃取),而后含有蛋白质的反胶束微粒与另外一个水相接触,又可使蛋白质从有机相中返回到水相中,即通过调节pH、离子种类或者强度等实现了蛋白质的反萃取。在此过程中,蛋白质等生物大分子主要以水壳的形式存在于反胶束中具有生理活性的极性核内,避免了与有机溶剂直接接触,最大程度地保持萃取过程中生物大分子的活性。
2 影响反胶束萃取蛋白质的因素
影响反胶束萃取蛋白质的因素包括蛋白质的表面电荷与反胶束内的表面电荷两者之间发生的静电作用、有机相形成的反胶束微粒大小以及蛋白质的疏水性等因素,这些都会影响到蛋白质在反胶束体系的溶解作用。
活性剂的种类和浓度都会对反胶束的形成以及所形成的反胶束微粒的大小产生影响。发生这种影响的主要原因或许是反胶束在萃取蛋白质时,蛋白质的分子尺寸和分子量均比较较大,这样就需要较大的含水极性核即水池来增溶蛋白质,但水池的大小是由反胶束微粒水的摩尔浓度与表面活性剂的摩尔浓度之间的比值决定的。因此,有机相所形成反胶束的直径越大,那么蛋白质进入胶束内核的阻力愈小,其容纳蛋白质的能力愈强,则更加有利于反胶束对蛋白质进行萃取。
水相的酸碱度即pH值对反胶束萃取蛋白质效果的影响主要表现在其能够改变蛋白质的表面电荷和解离状态上。pH可能改变蛋白质分子进入反胶束微粒的传质动力。当pH在蛋白质的等电点附近时,蛋白质在水中的溶解度很小,可能会影响其在反胶束体系的萃取率。不同的蛋白质有其对应的等电点,在萃取时需控制相应的pH。离子种类的影响主要体现在其可改变反胶束内表面的电荷密度上,反胶束内表面电荷密度愈大,有机相形成的反胶束微粒直径愈大,有利于蛋白质的萃取。离子强度的影响主要有两个方面:一是离子强度增大时,静电屏蔽作用增强,蛋白质与表面活性剂之间存在的静电吸引力会降低,从而导致蛋白质萃取率的降低;二是在反胶束内存在的双电层变薄以后,表面活性剂上极性基团之间存在的静电排斥力也会降低,此时有机相形成的反胶束微粒直径减小,蛋白质难以进入其中。另外,离子浓度对蛋白质在水中的溶解度亦有影响,在合适的盐浓度下,盐离子对蛋白质有增溶作用。
蛋白质相对分子量的大小对其萃取率的影响主要体现在:蛋白质分子量愈大,其传质推动力愈大,萃取过程愈难进行;且当反胶束的尺寸很小时,不能容纳大分子量的蛋白质。23
反胶束体系研究新进展反胶束酶体系
对于反胶束酶系统的硏究,主要集中于反胶束中酶的定位和结构,酶催化的动力学特征,酶的催化活性及稳定性等方面。利用紫外光谱核磁共振荧光等技术对反胶束中的酶进行硏究,表明酶的二级结构稍有扰动,而这种扰动与反胶束中的含水量有关。有些酶如Rhizopusarrhizus脂肪酶在溶解过程中二级结构变化较大。关于反胶束系统中酶的动力特征,认为符合Michales方程 ,但酶与反胶束的组成酶与表面活性剂的相互作用底物的分配与交换密切相关,是多变的复杂函数。目前,反胶束中酶催化反应的动力学模型 ,可归结为扩散模型和非扩散模型。反胶束中酶的催化活性,主要由反胶束中的含水量决定,在一定的含水量下 ,酶表现出远高于其在水中的活性,即所谓‘超活性” ,这对于反胶束酶系统在生化反应中的应用具有较重大的意义。另外,对于反胶束的一些物理化学特性如静电作用能反胶束的微结构反胶束中水的波谱特性等方面的硏究,近年来也在不断深入。4
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国