碰撞理论直观地说明了反应速率与活化能的关系,但没有从分子内部原子重新组合的角度揭示活化能的物理意义。随着人们对原子分子内部结构认识的深入,1935年 ,艾林(H. Eyring) 在量子力学和统计力学的基础上提出了过渡状态理论。
基本观点过渡状态理论认为,化学反应不只是通过反应物分子之间简单碰撞就能完成的,而是在碰撞后先要经过一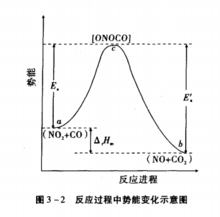 个中间的过渡状态,即首先形成一个活性基团(活化配合物),然后再分解为产物。活化配合物中的价键结构处于原有化学键被削弱、新化学键正在形成的一种过渡状态 ,其势能较高,极不稳定,因此活化配合物一经形成就极易分解。在反应历程中反应物分子必须越过势能垒才能经由活化配合物生成产物。两个分子碰撞前的能量越大,碰撞就越剧烈,分子可以在碰撞中获得足够的势能,从而改组反应物分子的化学键。在碰撞中获得足够能量的反应物分子 ,会形成一种过渡状态,称为活化体,亦称活化络合物。处于此种状态时旧的化学键己经削弱,新的化学键己经形成。活化体的寿命很短,一经生成,就很快向产物分子转化。全过程为:A+BC吸收能量形成A ..B..C ,放出能量生成AB+C。过渡状态理论认为正逆反应在进行过程中,都必须经过同一活化体这样一个过渡状态。过渡状态理论吸取了碰撞理论的合理部分,把活化能的概念提高到化学键的角度来理解。认为不同的物质分子化学键的键能不同,使得各种化学反应过程中改组化学键所需的能量不同 ,因而不同的化学反应具有不同的活化能,这是化学反应速度不同的内在因素。1
个中间的过渡状态,即首先形成一个活性基团(活化配合物),然后再分解为产物。活化配合物中的价键结构处于原有化学键被削弱、新化学键正在形成的一种过渡状态 ,其势能较高,极不稳定,因此活化配合物一经形成就极易分解。在反应历程中反应物分子必须越过势能垒才能经由活化配合物生成产物。两个分子碰撞前的能量越大,碰撞就越剧烈,分子可以在碰撞中获得足够的势能,从而改组反应物分子的化学键。在碰撞中获得足够能量的反应物分子 ,会形成一种过渡状态,称为活化体,亦称活化络合物。处于此种状态时旧的化学键己经削弱,新的化学键己经形成。活化体的寿命很短,一经生成,就很快向产物分子转化。全过程为:A+BC吸收能量形成A ..B..C ,放出能量生成AB+C。过渡状态理论认为正逆反应在进行过程中,都必须经过同一活化体这样一个过渡状态。过渡状态理论吸取了碰撞理论的合理部分,把活化能的概念提高到化学键的角度来理解。认为不同的物质分子化学键的键能不同,使得各种化学反应过程中改组化学键所需的能量不同 ,因而不同的化学反应具有不同的活化能,这是化学反应速度不同的内在因素。1
观点辨析近十几年来国内各种版本的《无机化学》和《普通化学》教材中,关于化学反应速度的过渡态理论的阐述中,有些提法笔者认为在教学过程中往往会引起学生的困惑。多数的教材都认为活化络合物的寿命很短,一经生成就很快向产物分子转化。正因为如此 ,多年来经过许多科学家的努力都没有能够将活化体从体系屮分离提取出来。并且都认为反应的速度取决于改组分子结构所需的能量,即取决于活化能。
但是,有个别的教材却提出这样的观点:对于A+BC反应生成AB+C这样的反应,其过程中必须经过势能很高的A..B..C,并认为 A+BC生成A..B..C较快,A..B..C生成AB+C较慢。其间叙述认为活化络合物不稳定,可分解 得到AB和C,亦可分解得到A和 BC。认为 ,反应物质通过过渡状态的速度 ,即活化络合物分解为产物的速度就是该化学反应的速度。
笔者认为上述有些提法是与一般教材不一致的,而且也是自相矛盾的。例如认为活化体是不稳定的,又认为A..B..C生成AB+C分解速度是较慢的;又如认为活化体分解为产物的速度即是化学反应的速度,这种观点似乎与化学反应的速度取决于反应中改组反应物分子结构所需的能量,即取决于活化能的观点不太一致。所以在教学过程屮往往引起学生理解上的困惑。本来化学反应速度的过渡态理论是一个正在探讨的理论,什么样的提法都不能定可否,但是将一些不成熟的论点引入教材,这是造成学生理解上困惑的主要原因。2
相关概念活化能反应物分子的平均势能与活化配合物的势能之差为正反应的活化能, 生成物分子的平均势能与活化配合物的势能之差为逆反应的活化能。在过渡状态理论中,活化能的实质为反应进行所必须克服的势能垒。由此可见,过渡状态理论中活化能的定义与分子碰撞理论不同,但其含义实质上是一致的。2
过渡态过渡态是基元反应反应坐标中能量最高的一点所对应的分子构型。处于过渡态的分子也称为活化络合物。理论上,活化络合物是极不稳定的,它向反应物和产物转化的概率相等;
1、绝对的不可逆反应中,在过渡态这一时刻,所有的碰撞分子都会转化为产物。
2、根据量子力学理论,活化络合物布居为零,过渡态是能量最高的一点,任何扰动都会导致它的改变,故无法分离出来,也是无法观测到的。1
意义过渡状态理论为认识化学反应奠定了理论基础。在过去的几十年里, 化学家们一直 在通过各种方法试图直接观察到过渡态,以求对化学反应有一个全面深人的理解。20世 纪 50年代,科学家们用快速动力学方法,可分辨出千分之一秒(ms) 的化学中间体。60年 代 ,又采用了分子朿技术来探讨分子碰撞的动态过程,实现了单个分子碰撞过程的研究, 但仍只是停留在对成分进行分析的水平上。70年代末,将激光技术和分子束技术相结合 用于研究化学反应的过程。80年代中期,将超短激光脉冲和分子束技术相结合制成了分 子“照相机”,其分辨率可达6 fS(飞 秒 ),大大小于分子的振动周期,使得跟踪化学反应 的过程成为了现实。人们终于可以直接观察到过渡态,并以此为基础,形成了一门新的学 科——飞秒化学。它是以飞秒为时标来研究化学反应的过程,对研究化学键的断裂和形 成是非常有用的。例如, 分子中有两个相同的C一I 键 ,但在进行化学反应的过程中,C一I 键的断裂却是分步进行的,通过飞秒化学对化学反应的探究可以得到证实。研究表明,第一个C-I键在不到0.5 ps(皮秒)时间内断裂,而第二个C-I键则需要50 ps以上的时间才能断裂。由此可见,飞秒化学的产生和发展是人们真正从微观层次上研究化学的过程,更新、深化和丰富了人们对化学反应过程的认识,从而达到有效地控制化学反应,并能通过激光对分子进行选键分解(即分子剪裁)。2
分子中有两个相同的C一I 键 ,但在进行化学反应的过程中,C一I 键的断裂却是分步进行的,通过飞秒化学对化学反应的探究可以得到证实。研究表明,第一个C-I键在不到0.5 ps(皮秒)时间内断裂,而第二个C-I键则需要50 ps以上的时间才能断裂。由此可见,飞秒化学的产生和发展是人们真正从微观层次上研究化学的过程,更新、深化和丰富了人们对化学反应过程的认识,从而达到有效地控制化学反应,并能通过激光对分子进行选键分解(即分子剪裁)。2
与碰撞理论比较碰撞理论是应用经典力学研究基元反应的化学动力学反应速率的理论。
其理论要点(假设)可归结为:(1)反应物分子是硬球;(2)反应发生必须进行碰撞;(3)碰撞分子对的相对平动能在联心线方向上的分量超过临界值Ec的是有效碰撞;(4)体系的能量分布遵守麦克斯韦-玻尔兹曼分布律。
但是该理论未考虑分子的复杂性,理论计算与实验结果有时差别较大,进一步的修正是考虑碰撞分子的相互取向和方位,用空间因子声来修正。该理论首先是由W.C.M.路易斯提出,并为许多学者充实和发展,理论上对指前因子以定量的解释,对于活化能基本上保持了阿累尼乌斯公式固有的概念。方位因子也由实验确定,但所建立的化学反应的模型开始摆脱以阿累尼乌斯公式作为经验事实接受的状况,是有其历史功绩的。1
本词条内容贡献者为:
李廉 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国