有机物分子中的两种化学结构键。椅式构象的直立键和平伏键能发生相互转变的概念,对预测取代环己烷的优势构象极为重要。例如,一元取代环己烷中的R基,由于两种椅式构象的相互转变,可以处在直立键上,也可以处在平伏键上。
基本概念如图一,在其中三个伸向环上方,三个伸向环下方,这六个C-H键称为直立键,或称a键。另有六个C-H键则伸向环外,大体上与环的平面相平行(图1,用虚线表示者),其中三个略向上,三个略向下,这六个C-H键称为平伏键,或称e键。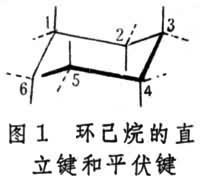
在室温下椅式构象可以极快的速率从一种椅式构象转变为另一种椅式构象,最后达成两种椅式构象之间的动态平衡。在发生这种转变时,一种椅式构象的直立键则随着转变成另一种椅式构象的平伏键,而平伏键则转变成直立键(如图2)。

椅式构象的直立键和平伏键能发生相互转变的概念,对预测取代环己烷的优势构象极为重要。例如,一元取代环己烷中的R基,由于两种椅式构象的相互转变,可以处在直立键上,也可以处在平伏键上。通常,以处在平伏键上的构象较为稳定,占优势。这种构象称为e键型;反之称为a键型(图3)。
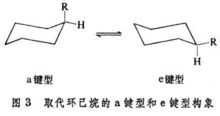
通过纽曼投影式可以看到,a键型的取代基R与碳架处于邻位交叉式的位置上,而e键型的则处于对位交叉式的位置上并伸向环外,所以在一般情况下一元取代环己烷的e键型构象较a键型稳定而占优势。1
相关概念构型和构象构型(configuration)指分子内原子或基团在空间“固定”排列关系,分为:顺反异构,旋光异构二种。
构象(conformation)指围绕单键旋转产生的不同的分子形象。
构型和构象在有机合成、天然产物、生物化学等研究领域非常重要。例如六六六有九种顺反异构体,其中只有γ-异构体具有杀虫活性。
人体需要多种氨基酸,其中只有L-型具有活性作用。
手性(chiral)在医药、农药、食品添加剂、香料等领域需求越来越多。手性液晶材料、手性高分子材料具有独特的理化性能,成为特殊的器件材料。一个新兴的高新技术产业-手性技术(chirotechnology)正在悄然兴起。1
顺反异构由于双键或环的存在,使得旋转发生困难,而引起的异构现象。
命名:顺、反 (Cis,Syn-;Trans, Anti)。 现在用 “Z”, “E”表示。
Z:Zusammen 二个大的基团都在一侧(相当于顺) E:Entgegen 二个大的基团分在两侧 (相当于反)
关于C=N和N=N双键的命名
含C=N双键的化合物主要是指醛肟和酮肟(醛或酮与羟胺NH2OH反应得到)
孤对电子的序数为“0”。
文献上,现在还沿用顺、反命名。把-OH,-H在一侧的叫顺式,Cis-,Syn-;把-OH,-H在两侧的叫反式,Trans-,Anti-。
N=N双键也用顺反命名:一般反式稳定,减少了基团间的排斥作用。
(反式对称性好,分子排列更为紧密、有序,有较高的熔点,较低的溶解度(在水中,因极性小),燃烧热、氢化热比顺式低。
对于环状化合物仍用顺反而不用E、Z,把环看成是一个平面的,取代基团在同一侧的为顺式。 如果有三个以上时,选一个参考基,用小写r(reference group)表示,再和别的取代基比较与之关系。1
对映异构手性分子(chiral molecule)、手性碳,从上世纪七十年代起广泛使用,能够使平面偏振光向左或向右旋的物质称为旋光性物质(或光活性物质)。
手性分子是指一个分子与其镜象不能重合。 手性分子一定是光活性物质。
对映异构体:二个互为镜象,但不能重合,是二种不同化合物。旋光能力相同,但方向相反,如同左、右手。
考察一个分子是否为手性分子,可以从有无手性碳出发,但是最根本是要看分子对称性来考察。
符合手性分子的充要条件:
①无对称面; ②无对称中心; ③无交换对称轴。
三者不可缺一,但一般说来,只要求分子是否有对称面或对称中心即可了。(注意:对称轴不能作为判据。)1
构象和构象分析构象:沿C-C单键旋转,分子产生不同形象,称为构象。
单键旋转能垒一般为3~10千卡/摩尔,在室温下热运动可以越过此能垒,各种构象迅速互变,分子在某一构象停留时间很短(﹤10-6秒),因此不可能将某一个构象分离出来。
研究构象对于了解化合物结构、反应历程和反应取向等方面非常重要。 许多分子呈现有张力,就是由于非理想几何形状造成的。分子将尽可能利用键角或键长的改变使能量达到最低值,就是说一个分子总是要采取使其能量为最低的几何形状。2
分子内张力空间张力=成键张力(单键伸长或缩短)+键角张力+扭转张力+非键张力
分子内张力是上述四种张力之和。
1、 角张力(亦称Baeger张力):它是由于正常键角改变产生的。
2、 键张力:是由键的伸缩使正常键长改变而产生的张力。
3、扭转张力(pitzer张力):它是由于优势构象二面角改变而产生的张力。两个连接四面体碳原子,他们都倾向于成为交叉式,与交叉式任何偏差都会引起一定张力,希望恢复到交叉式的最稳状态,这种张力就是扭转张力。
4、非键张力(范德华张力):非键合的原子或基团相互作用。
在小环化合物中(3~4元环)主要存在有角张力;普通环(5~7元环)各种张力都不显著,6元环无角张力、无扭转张力。 在中环(8~11元环)主要存有跨环张力。在大部分环状化合物中(除大环外)大部分存在扭转张力。2
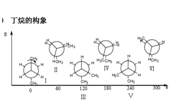
丁烷的构象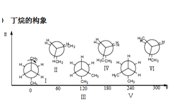
Ⅰ对位交叉,Ⅱ部分重叠,Ⅲ邻位交叉,Ⅳ全重叠式,Ⅴ邻位交叉,Ⅵ部分重叠
Ⅰ为优势构象
从丁烷的势能图可见,有三个能量极大值,全重叠式为最大值;三个能量极小值,对位交叉为最小值。
稳定性次序:对位交叉﹥邻位交叉﹥部分重叠﹥全重叠
两个邻位交叉Ⅲ、Ⅴ比对位交叉式略高0.8kcal/mol,是由于甲基之间的排斥作用,但由于能量相差不大,在室温下,两者都可存在。对位交叉占68%,邻位交叉占32%。
正丁烷体系不能分离出单一的构象异构体,他们这类化合物的性质是各种构象异构体的平均值。2
环己烷构象环己烷构象(cyclohexane conformation),可分椅式(chair)、船式(boat)、扭船式以及半椅式。
若环己烷分子中碳原子在同一平面上时,其C—C键角为120度,存在较大的角张力。实际上分子自动折曲而形成非平面的构象,在一系列构象的动态平衡中,椅式构象(chair conformation)和船式构象(boat conform ation)是两种典型的构象。在常温下,由于分子的热运动可使船式和椅式两种构象互相转变,因此不能拆分环己烷的船式或府式中的某一种构象异构体。2
构象对化学反应速度的影响(1) 酯的水解
反式比顺式在碱性条件下水解快20倍。 碱性、酸性水解,四面体机制。 碱性水解条件下,HO-进攻羰基碳。
在反式酯中,形成过渡态中,空间比较宽敞,有利。
而在顺式酯形成的过渡态中,双1,3相互排斥,过于拥挤,不利。
(2)环己酮的还原
用LiAlH4-t-BuOH、NaBH、Na醇等作为还原剂时,真正的还原剂H-体积小,从羰基两侧进攻机会相当,由于e醇比较稳定,反应受“产物生成控制”。此时a 9%,e 91%。
如果还原剂为或BH(CHMeCHMe2)2,其体积比较大,则产物以a-OH为主,反应受“立体途径控制”。2
构象对分子物化性质的影响分子的构象不仅影响化合物的物理和化学性质,而且还对一些生物大分子(如蛋白质、酶、核酸)的结构和性能产生影响。许多药物分子的构象异构与药物生物活性密切相关,药物受体一般只与药物多种构象中的一种结合,这种构象称为药效构象。药物的非药效构象异构体很难与药物的受体结合,通常低效或无药效。例如,抗篾颤麻痹药物多巴胺作用于受体的药效构象是对位交叉式。2
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国