加氢酰化反应是一种醛分子加成于烯烃或炔烃上,形成酮并增加碳链的有机反应。该类反应需要金属催化剂的参与,且分子内反应优先于分子间反应。与带有三键的炔类底物发生反应,产物为环酮化合物。1
简介加氢酰化反应,英文名称为hydroacylation。它是指含有不饱和键(例如烯烃)的有机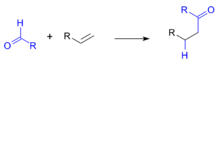 化合物发生加氢和酰基化(酰化)而生成饱和羰基化合物的反应。反应过程中需要一定的金属催化剂参与到反应,主要涉及金属试剂对C-H键氧化加成生成金属化合物,之后对不饱和键的插入、还原消除最终得到加氢酰化的产物。
化合物发生加氢和酰基化(酰化)而生成饱和羰基化合物的反应。反应过程中需要一定的金属催化剂参与到反应,主要涉及金属试剂对C-H键氧化加成生成金属化合物,之后对不饱和键的插入、还原消除最终得到加氢酰化的产物。
加氢酰化反应是制备醛、酮的有效方法,在有机合成反应中应用很广泛,一些经典的有机合成方法不奏效的情况下使用这种反应可以得到所需要的中间体或者产物。如右图所示加氢酰化的通式。2
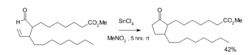
举例该反应最早发现于1972年,化学家K.Sakai合成一种前列腺素的路线就应用了此类化学反应。在该加氢酰化反应中,四氯化锡作为反应试剂,并应用了等当量的威尔金森催化剂的氯仿、乙腈或苯溶液作为催化剂。反应由于脱羰作用生成了等当量的环丙烷。如下图所示的反应方程式,该反应的收率达42%。
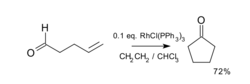
首个该反应的催化应用于1976年被化学家米勒报道,该反应中,在威尔金森催化剂与饱和的乙烯溶液的条件下,可将4-戊烯醛转化为环戊酮。该反应的收率达72%。另一种合适的催化剂为铑正离子络合物Rh(dppe)ClO4。
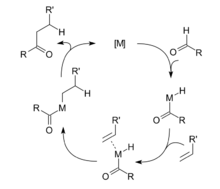
反应机理通常的反应机理为:第一步金属对醛碳-氢键的氧化加成,而后对烯烃的加成,最后发生还原消除。一种可能产生的副反应为,酰基金属氢化物RCH2(CO)MH通过中间体RCH2M(CO)H的脱羧反应,形成烷烃RCH3与M(CO)。如下图所示的循环机理3。
不对称加氢酰化第一例加氢酰化的不对称反应被首先于1983年被化学家James与Young发表(动力学拆分),1989年由Sakai发表了不对称合成法,他们都应用了铑催化剂并使用了手性的二膦配体,如下图所示的Me-DuPhos。该反应中收率达85%,ee值大于95%。是一个很好的选择性反应。

本词条内容贡献者为:
李廉 - 副教授 - 中国矿业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国