盐类在溶液中,与水作用而改变溶液的酸碱性的反应叫作盐类的水解。水解常数的大小表示盐的水解达到平衡时,水解程度的大小,水解常数的大小取决于盐中弱酸或弱碱的解离常数的大小。
盐类水解既不含H+又不含OH-的盐溶于水而显酸碱性,是由于盐的一个或两个离子和水中的H+和OH-结合,从而使水的电离平衡移动的结果。盐的组分离子与溶液中水电离出的H+和OH-作用产生弱电解质的反应称盐类的水解。
水解常数的表示盐的组分离子与水发生反应而改变溶液的酸度,涉及质子的转移,所以也是一种酸碱反应。
弱酸强碱盐的水解常数NaAc、KCN、Na2CO3、NaClO3等属于弱酸强碱盐,以NaAc为例,在NaAc水溶液中,同时存在以下反应:
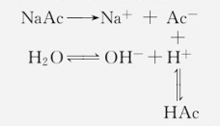
所以,NaAc的水解作用实质是Ac-与H2O作用生成弱酸HAc的反应。弱酸强碱盐的水解,实质上是酸根离子发生了水解。
水解过程用离子方程式表示为: Ac-+ H2O ⇌ HAc + OH-。1
当水解达到平衡时:
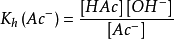
Kh为水解反应的平衡常数,即水解常数。对于一元弱酸强碱盐的水解反应,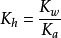 (Kw是水的离子积常数,Ka是弱酸的解离常数)。在常温下,水的离子积常数Kw为一常数,故弱酸强碱盐的水解常数值Kh取决于弱酸的电离常数Ka的大小。Ka越小,即酸越弱,则Kh越大,说明该盐的水解程度越大;反之,Ka越大,Kh越小,水解程度越小。
(Kw是水的离子积常数,Ka是弱酸的解离常数)。在常温下,水的离子积常数Kw为一常数,故弱酸强碱盐的水解常数值Kh取决于弱酸的电离常数Ka的大小。Ka越小,即酸越弱,则Kh越大,说明该盐的水解程度越大;反之,Ka越大,Kh越小,水解程度越小。
强酸弱碱盐的水解常数NH4Cl是强酸弱碱盐的一种,在溶液中的水解过程如下:
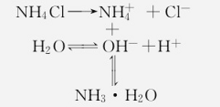
NH4Cl的水解实质是盐中的NH4与水中的OH-作用生成了弱碱NH3·H2O,水解反应为:NH4++ H2O ⇌ NH3·H2O + H+。1
水解达到平衡时,水解常数
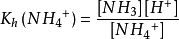
对于强酸弱碱盐,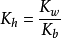 (Kw是水的离子积常数,Kb是弱碱的解离常数),组成该盐的碱越弱,水解常数Kh越大,水解程度也就越大。
(Kw是水的离子积常数,Kb是弱碱的解离常数),组成该盐的碱越弱,水解常数Kh越大,水解程度也就越大。
弱酸弱碱盐的水解常数弱酸弱碱盐在水中能全部解离成阴、阳离子,其阳离子和阴离子都发生水解,也称双水解,弱酸弱碱盐的水解程度较弱酸强碱盐和强酸弱碱眼都要大。以NH4Ac为例,
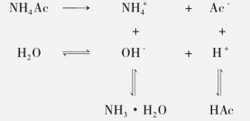
其水解方程式为 :NH4++ H2O +Ac-⇌ NH3·H2O + HAc 。2
水解常数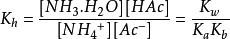
弱酸弱碱盐阴阳离子的水解能相互促进,使水解进行得更彻底,其水溶液的酸碱性取决于生成的弱酸和弱碱的相对强弱。
多元弱酸盐的水解常数多元弱酸的水解比较复杂,它们的水解过程与多元弱酸的电离相似,也是分步进行的,每一步都有相应的水解常数。但通常由于第一步的水解程度远远大于第二步的水解程度,主要考虑第一步的水解。2
常见物质的水解常数
|| ||
*此水解常数为25 ℃时,根据解离常数计算得出,解离常数(25 ℃)可以从化学手册上查得。
本词条内容贡献者为:
蒲富永 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国