成键轨道是分子轨道理论中的的一个化学概念。分子轨道是由原子轨道的线性组合而成,分子中的电子围绕整个分子运动,其波函数称为分子轨道。分子轨道由原子轨道线性组合而成,组合前后轨道总数目不变。若组合得到的分子轨道的能量比组合前的原子轨道能量低,所得分子轨道叫做“成键轨道”;反之叫做“反键轨道”;若组合得到的分子轨道的能量跟组合前的原子轨道能量没有明显差别,所得分子轨道就叫做“非键轨道”。1
这里的“键”指的是共价键。
学习成键轨道之前需要了解分子轨道理论的相关知识。
定义在对称性匹配的条件下,分子轨道能量较原来的原子轨道能量低,有利于成键,成为“成键(分子)轨道”(bonding orbital),如σ、π轨道。2成键轨道都会有一个对应的能量较原来原子轨道高的反键(分子)轨道(antibonding orbital)。
分子轨道理论(简称MO法)是一种应用较为普遍共价键理论,它将分子看作一个整体,由分子中各原子间的原子轨道重叠组成若干分子轨道,几个原子轨道组合后可得几个分子轨道,然后将电子逐个填入分子轨道,如同原子中将电子安排在原子轨道一样。填充顺序所遵循的规则与填入原子轨道相同,也根据能量最低、泡利不相容原理和洪特规则,电子属于整个分子。3
以双原子分子为例,两个原子轨道可以组合成两个分子轨道,当两个原子轨道(即波函数)以相加的形式组合时,可得成键分子轨道,成键分子轨道两核间电子云密度增大,能量降低;当两个原子轨道(即波函数)以相减的形式组合时,可得反键分子轨道,反键分子轨道中两核间电子云密度减小,能量升高。如H2分子中,2个H原子的1s轨道经组合后形成两个分子轨道,一个为成键分子轨道,另一个为反键分子轨道,见下图。氢分子中的两个电子根据规律应分布在成键分子轨道中,并且自旋状态相反。由于电子进入成键分子轨道后能量低于原子轨道,因而形成能稳定存在的氢分子。3
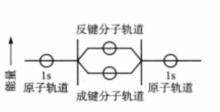
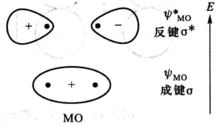
分类σ成键轨道当两个原子轨道沿着连接两个原子核轴线(x轴)以“头碰头”方式组合成的分子轨道称为σ分子轨道。当选定键轴为X轴时,两个原子的n s轨道沿连接两个原子核的连线进行组合,可得到两个σ分子轨道,其中能量较低的分子轨道为成键分子轨道。用σns表示。另一个能量较高的就为反键分子轨道,用σ*ns表示。2
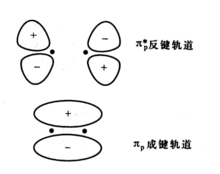
π成键轨道两个原子轨道垂直于轴线以“肩并肩”方式组合成的分子轨道称为π分子轨道。两个原子的npy轨道或npz轨道垂直于两个原子核的连线(x轴)以“肩并肩”方式组合成两个π分子轨道。其中成键π分子轨道用符号πnpy或πnpz表示,反键分子轨道用符号π*npy或π*npz表示。2
轨道形成三原则成键轨道、反键轨道组成分子轨道,这是由原子轨道进行线性组合后的结果。这种线性组合需要遵循以下三条基本原则:
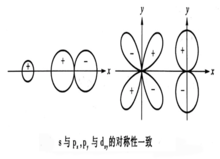
对称性一致原则对称性一致原则是指对核间连线呈相同对称性的轨道,才有可能进行线性组合。除s-s,p-p组合之外,还有s-p.沿x方向的组合,两者的对称性一致,可以组成σ分子轨道。另外py-dxy沿x方向,对称性一致,也可以组合成有效的π分子轨道。如下图:4
能量相近原则能量相近原则是指轨道能量相近时彼此间才有可能进行线性组合。根据元素第一电离能的值估算,可得到以下原子轨道近似的能量数据:4

H的1s,O的2p,Cl的3p,这3条轨道能量相近,彼此间均可组合,形成分子轨道。但Na的3s比上述3条轨道的能量高许多,不能与之组合。实际上Na与H,Cl,O一般不形成共价键,只以离子键相结合。4
最大重叠原则最大重叠原理是指在对称性一致、能量相近的基础上,原子轨道重叠的程度越大,越容易形成分子轨道即生成成键轨道,或者说形成的共价键越强。4
科研意义成键轨道所反射出的分子轨道理论比较全面地反映了分子中电子的各种运动状态,运用该理论可以说明共价键的形成.也可以解释分子或离子中单键和三电子键的形成,但在解释分子的几何构型时不够直观。分子轨道理论和价键理论都以量子力学原理为基础,在处理化学问题时各有优势:它们可以互为补充,相辅相成,为人们解释化学结构和某些化学现象提供了可靠的理论依据。2
本词条内容贡献者为:
蒲富永 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国