在电解质溶液里,离子跟水分子结合生成的带电微粒,叫水合离子。例如[Fe(H2O)6]2+,[Mg(H2O)6]2+等。在水溶液里的离子大都以水合离子形式存在。
有些离子与水结合得比较牢固,而且结合的水分子有一定的数目,以络离子的形式存在,例如[Cu(H2O)4]2+,[Al(H2O)6]3+等。有些离子所结合的水分子不很牢固,而且结合的水分子的数目也不十分稳定,例如Na+和Cl-等,我们可用[Na(H2O)m]+和[Cl(H2O)n]-表示。
定义大多数的化学反应是在水溶液或含水体系中进行的。当盐类溶于水后,阴、阳离子和强极性的水分子发生水合作用,在它们的周围各配有一定数目的水分子,就会生成具有由一定数目水分子配位的水合离子。1
形成过程水分子作为配体通过配位键与其它质点相结合,而且配位水分子的数目也是由配位键所决定的。对于水合阳离子的形成过程即是:由于水分子是极性分子,存在正负偶极,则溶解后的阳离子和水分子间通过静电引力相互吸引,阳离子吸引水分子的负端,使水分子以配位键配位在阳离子周围形成水合阳离子,如H3O+、[Fe(H2O)6]3+等,一般为简化起见,书写水合离子时,通常可省略配位水分子。1
一般来说,离子愈小,它所带的电荷愈多,则作用于水分子的电场愈强,故它的水合热愈大。而碱金属离子是最大的正离子,离子电荷最少,因此它的水合热常小于其它离子,这样由于碱金属、碱土金属元素(Li、Be、Mg除外)电荷低、半径大的特征,相应它们对水分子的吸引力比较弱,大部分不易形成水合阳离子。而对于过渡元素、Al等金属由于它们的电荷高、半径小,对水分子的吸引力强,水合焓较大,所以多数易形成水合阳离子。由此可知金属离子不同,其水合能力也有所不同。1
结构组成单核水合离子水合质子
H。F。Halliwell与S。C。Nyburg于1963年推算出质子的水合焙为1091KJ/mol。可见溶液中不存在裸露的H+,而是以水合质子[H(H2O)n]+形式存在,式中n=1、2、3。。。。。。。
根据分子轨道理论计算,离子H3O+呈平面三角形。因此,H9O4+离子中的四个氧在同一平面上,结构如下图(虚线表示氢键):2
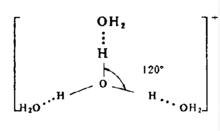
在垂直于此平面上,还有一水分子与中心氧原子以范德华力连结。
2。水合阳离子
在晶体中水合阳离子的结构与溶液中是不同的。现分述如下:
(1)晶体中水合阳离子结构
在含有结晶水的盐类中,绝大多数的水合阳离子是水合配离子,即水分子藉氧原子的孤对电子向金属阳离子的空轨道(多为杂化轨道)配位,形成电价或共价的配位键,常见水合离子结构如下图所示:2

在明矾中,在K+周围的六个H20是靠静电力结合的,一般不称为六水合钾配离子。
(2)溶液中水合阳离子结构
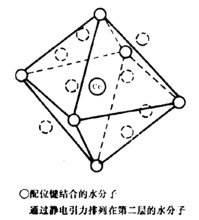
据Bockris研究指出,溶液中水合阳离子的水合水可分为一次水合水和二次水合水(又称为初级水合水和次级水合水)。初级水合水是靠配位键与离子成键(因此,称为化学水合),结合牢固,此水分子失去平动自由度,常伴随离子一起移动,此即水合配离子。次级水合水是通过静电作用(离子一偶极作用)在水合配离子上再结合的水分子。由于相距较远,结合力较弱,常不伴随离子一起移动。例如水合钻离子[Co(OH2)n]2+,据配位化学知Co2+在水中是稳定的[Co(OH2)6]2+配离子存在,其配位数或水合数为6,这六个水在Co周围呈八面体分布。但用压缩系数法、水化嫡法测得其水合数为10~14,这是二级水合水同时被测出的结果,即还有八个水分子处于初级水合所形成的八个面的中心连线上,通过静电作用而被固定在离Co2+的较远位置上,其结构见下图:2
2。水合阴离子的结构
阴离子的电子较多而无空轨道,且半径较大。因此,阴离子与水分子通常靠静电引力或氢键作用形成水合阴离子,一般不能形成配位键,所以水合阴离子的水化数较小(如I-一的水合数常认为是0或1),结构亦简单。
(1)晶体中水合阴离子结构
存在晶体中的结晶水绝大多数是配位于阳离子周围,即以配位水形式存在,少数结晶水是与阴离子以氢键结合,此属于结构水。如胆矾中有四个H2O配位于Cu2+周围,一个H2O与SO42-以氢键键合形成一个水合硫酸根离子,其结构见下图:2
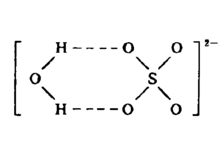
也有人认为此结构水是与二个SO42-以氢键相结合。
(2)水溶液中水合阴离子结构
经x-射线测定认为,在水溶液中卤离子(X-)的周围,有六个位于八面体顶点的水分子,其间以弱的静电引力结合,因此,对于水合卤离子一般不写其水合形式:[X(H2O)6]-,而简写为X-。
对于水合氢氧根离子:[OH(H2O)m]-(m=1,2,3。。。。。。)中氢键起着决定性作用。如下图所示:2
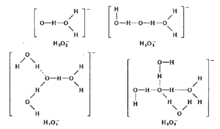
可见水合氢氧根离子的结构与水合质子结构相似。
总之,一切阴离子在水溶液中也是要发生水合的,只是周围的水分子数较少,结合力较弱而已。2
多核水合离子在多核水合离子中存在桥键结构。
(1)双核水合离子结构
已证明Na2CO3·10H2O晶体中存在[NA2(OH2)10]2+离子,水分子近似地以八面体配位在Na+离子周围,其中两个水分子为两个Na+所共有,如下图:2
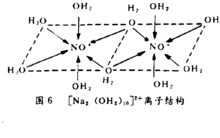
(2)多核水合离子结构
在LiAlO4·3H2O晶体中存在柱形离子,每个Li+由六个H2O配位,如下图:
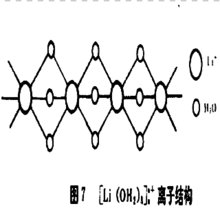
(3)混合多核水合离子结构
在KF·4H2O晶体中,K+与F-均与六个H2O成八面体配位,其间通过共用顶角和棱边组成长链,而看不到K+—F-的直接键合,因此KF·4H2O的晶体结构常用水分子稀释了KF晶格来解释,如下图:2
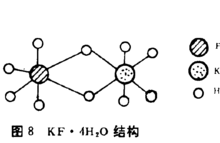
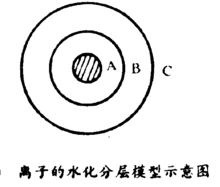
结论水合离子结构均可用Frank和Wen提出的水化分层模型来解释。其模型示意图如下图。在离子周围的第一层A是冻结在它表面的水分子,是与离子靠配位键结合,故称为化学水化层。第二层B中水分子与离子靠静电引力结合,称为物理水化层。第三层C是不受离子影响的正常水分子层。2
本词条内容贡献者为:
蒲富永 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国