四氯化钒(vanadium tetrachloride),也称为氯化钒(IV),化学式为VCl4,分子量为192.75。
为粘稠的红褐色液体,化学性质不稳定。在橡胶工业中,四氯化钒可以催化烯烃的聚合反应。
物化性质四氯化钒(化学式:VCl4)是钒(V)的氯化物,粘稠的红褐色液体 , 对潮湿敏感,在潮湿空气中冒烟。密度为1.816
, 对潮湿敏感,在潮湿空气中冒烟。密度为1.816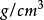 ,熔点为−28℃,沸点为154℃。1
,熔点为−28℃,沸点为154℃。1
在空气中或遇水后分解冒白烟。溶于无水酒精、乙醚、氯仿和醋酸等有机溶剂。化学性质不太稳定,由金属钒或氮化钒通干燥氯气后加热而得。用于医药和制备钒及钒的有机化合物和二氯化钒、三氯化钒等。可用于制备其他很多钒化合物,包括氯化二茂钒。它与许多配体形成加合物,如与四氢呋喃反应生成VCl4(THF)2。
四氯化钒呈顺磁性,它比反磁性的四氯化钛多一个价电子。它是少数室温下为液体且为顺磁性的化合物之一。与同族的VF5、NbCl5和TaCl5不同,VCl4可由金属钒氯化制备,氯气的氧化性不足以将钒氧化至VCl5。
此外,四氯化钒在沸点下分解,生成三氯化钒和氯气:
2 VCl4 → 2 VCl3 + Cl22
反应及应用(1)有机合成中,VCl4可使酚偶联,比如与苯酚反应生成4,4'-联苯酚。化学方程式如下:
2 C6H5OH + 2 VCl4 → HOC6H4-C6H4OH + 2 VCl3 + 2 HCl
(2)橡胶工业中,VCl4可以催化烯烃的聚合反应,机理与齐格勒-纳塔催化剂类似。
(3)因其高氧化能力,VCl4与HBr反应生成VBr3。反应经由中间产物VBr4,室温下分解放出Br2。化学方程式如下:
2 VCl4 + 8 HBr → 2 VBr3 + 8 HCl + Br23
安全信息**危险品标志:**有毒
**安全标识:**S26S27S45S36/S37/S39
**危险标识:**R14R34R23/24/25
危险品运输编号:UN 2444 8/PG 13
**室温下:**VCl4是可挥发且有较强氧化性的液体,遇水迅速水解生成HCl。
**火灾危险:**有强腐蚀性,遇水、酸类或明火有火灾危险。
**处置方法:**使用干粉、二氧化碳灭火剂,不可用水。
**泄漏处置:**须穿戴防护用具进入泄漏现场;保持现场通风;喷水减少泄漏物挥发量;禁止将水喷洒在泄漏物上;用蛭石、干砂、泥土或类似物质吸附泄漏物,置于密闭容器内。
毒理学数据试验方法:口服。
摄入剂量:160毫克/千克。
测试对象:啮齿动物-鼠。
毒性类型:急性。
毒性作用:详细的毒副作用没有报告以外的其他致死剂量值。2
接触防范四氯化钒刺激眼睛、鼻、咽喉、肺,会引起咳嗽、呼吸短促、眼睛损害;吸入较高浓度该物质,导致肺炎及肺水肿,甚至死亡。
皮肤接触: 脱掉被污染衣服,用大量肥皂、水冲洗皮肤。
眼睛接触: 用大量水冲洗至少30分钟;就医。
吸入: 将患者移至新鲜空气处,呼吸停止时,施行呼吸复苏术;心跳停止时,施行心肺复苏术;就医。
食入: 其它:留医观察24~48小时,以免延误肺水肿的诊治。
呼吸系统防护: 选用适当的呼吸器;定期检查肺功能。
眼睛防护: 戴防化镜,保护眼睛。
防护服: 穿戴清洁完好的抗酸防护用具(防护服、手套、帽子、鞋),保护皮肤。
存储运输储存于密闭容器内,置于凉爽、通风处;隔热,远离易燃物,避水;当储存处温度降至20℃以下储存;穿专用防护用具,并在惰性气体保护下方可开启容器。须贴“腐蚀”标签,禁止航空客运、铁路运输,航空货运限量运输。4
计算化学数据1、疏水参数计算参考值(XlogP):无
2、氢键供体数量:0
3、氢键受体数量:0
4、可旋转化学键数量:0
5、互变异构体数量:无
6、拓扑分子极性表面积:0
7、重原子数量:5
8、表面电荷:0
9、复杂度:19.1
10、同位素原子数量:0
11、确定原子立构中心数量:0
12、不确定原子立构中心数量:0
13、确定化学键立构中心数量:0
14、不确定化学键立构中心数量:0
15、共价键单元数量:12
本词条内容贡献者为:
杨剑虹 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国