是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。也用作肥料和饲料添加剂。用于医药,电焊条辅料等,用作生产电解金属锰的原料。
简介中文名称:碳酸锰
中文别名:碳酸亚锰
英文名称:Manganese(II)carbonate 、Manganous carbonate
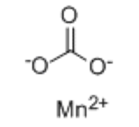
分子式:MnCO3
CAS编号:598-62-9
EINECS号:209-942-9;208-915-9
性状:新沉淀者为粉红色至几乎白色粉末,在空气中渐变为浅棕色。受热分解。溶于稀酸,不溶于水和乙醇。相对密度3.1。
管制信息:本品不受管制。1
质检信息
|| ||
性质物理性质玫瑰色三角晶系菱形晶体或无定形亮白棕色粉末。相对密度3.125。几乎不溶于水,微溶于含二氧化碳的水中(即碳酸),不溶于醇和液氨。1
化学性质溶于稀无机酸,微溶于普通有机酸中。在干燥空气中稳定。潮湿时易氧化,形成三氧化二锰而逐渐变为棕黑色,受热时分解放出二氧化碳。与水共沸时即水解。在沸腾的氢氧化钾中,生成氢氧化锰。1
包装储运用内衬聚乙烯塑料袋的木桶包装,每桶净重50kg。 应贮存阴凉、通风、干燥的库房中。应防止受潮、受热及变质。运输时要防雨淋和日晒。装卸时要轻拿轻放,防止包装破损。 失火时,可用水、砂土和灭火器扑救。1
用途它是制造电信器材软磁铁氧体、合成二氧化锰和制造其他锰盐的原料,用作脱硫的氧化剂、瓷釉、涂料和清漆的颜料,也用作肥料和饲料添加剂。它同时用于医药、电焊条辅料等,且可用作生产点解金属锰的原料。1
安全信息RTECS号:OM2470000
安全术语:S22;S24/25;S22;S24/25
毒理学数据:598-62-9(Hazardous Substances Data)
碳酸锰主要为慢性中毒,损害中枢神经系统尤以锥体外系统突出。
中毒处理方法:
1、 皮肤接触需脱去污染的衣着,用流动清水冲洗;
2、 眼睛接触需提起眼睑,用流动清水或生理盐水冲洗,就医;
3、 吸入需脱离现场至空气新鲜处,如呼吸困难,给输氧,就医;
4、 食入需饮足量温水,催吐,就医。1
工业标准碳酸锰是生产电解锰的重要原料,碳酸锰的工业标准如下:
锰含量≥8%
铁含量≤3%
浸出率≥90%
耗酸比1:1.0以下。
生产厂家对硅、镁、钙、铝要求各不相同。
湖南区碳酸锰元素含量参考:
钙 5~11%
铝 3~9%
硅30~43%
铁3~7%
镁2~12%2
实验室制备法前言实验室制备碳酸锰,一般用二氧化锰作原料。二氧化锰是一种重要的氧化物,呈酸性,为黑色粉末,在中性介质中很稳定,在碱性介质中可制备高锰酸钾,在酸性介质中有强氧化性。二价锰离子可在溶液中稳定存在,与碳酸氢铵或碳酸钠等反应生成碳酸锰。实验室由二氧化锰制碳酸锰,首先要用还原剂把二氧化锰还原成二价锰并转移到溶液中,再与碳酸氢盐或碳酸盐反应,生成碳酸锰沉淀,最后漂洗、除杂、蒸发、浓缩、结晶,可得产品。可使用的还原剂有多种,如炭粉、浓盐酸、亚硫酸钠、过氧化氢、草酸等。
还原二氧化锰时应注意以下细则:
一、用炭粉作还原剂时,需要将二氧化锰与一定比例的炭粉研细混匀,高温灼烧后生成氧化锰,加热温度要高,最好能煤气灯灼热,加热时间也要长,否则产量很低。再用浓硫酸分解成硫酸锰。
二、用浓盐酸作还原剂时,反应很快也很安全,但产生大量氯气,要作适当处理。反应时,部分氯气溶在溶液中,要经较长时间的水浴加热才能赶去。
三、用过氧化氢作还原剂时,反应较完全,但过氧化氢要分批缓慢加入,否则反应太激烈,过氧化氢分解也较多。过量的过氧化氢一定要使其分解完全,否则会影响后面的反应。
四、用草酸作还原剂时,在原料中含铁较少时,反应较完全。若含铁较多时,则会形成草酸亚铁沉淀。用过氧化氢或草酸作还原剂时需同时使用稀硫酸,最后生成硫酸锰。
不论选用何种还原剂,在与碳酸盐进行复分解反应时,加入试剂的速度不能快,且要边搅拌便滴加,避免局部碱性过大而使二价锰氧化。故在制备过程中要控制反应的pH值在3~7间,但pH又不能太小,否则会使碳酸盐分解。
基于以上各点及多方面因素,综合考虑,决定采用草酸作还原剂。此次实验的基本思路是:将草酸加入到6mol/L硫酸中,微热,再加入二氧化锰,得到硫酸锰,净化后再加入过量的碳酸氢铵即可制得碳酸锰。2
实验原理二氧化锰在酸性介质中有强氧化性,其与稀硫酸、草酸共同作用生成硫酸锰,过滤除去所得溶液中不溶物,再用硫化氢净化(2.5~3小时)以除去重金属等杂质,加热煮沸,趁热过滤即得纯净的硫酸锰溶液。然后在反应器中与碳酸氢铵溶液进行复分解(298~303K),即生成碳酸锰。2
实验步骤(1)称取5gMnO2于150mlA烧杯中,加入几滴蒸馏水润湿成粘稠状;
(2)称取8gH2C2O4-2H2O于100mlB烧杯中,加6ml蒸馏水使其溶解,再加入12ml,6mol/L的H2SO4,并用洁净的玻璃棒搅匀溶液(若H2C2O4-2H2O晶体较难溶解,可以采取再加一些少量蒸馏水或稍稍加热B烧杯等方法,使其尽量全部溶解,这样就会保持溶液中H2C2O4的浓度,有利于后续的氧化还原反应的进行。);
(3)将B烧杯中的溶液分三次.缓缓依次加入A烧杯中每次加入的时间间隔约为2~5分钟,烧杯中不再产生气泡则说明烧杯内的反应趋于反应完全了,此时烧杯内溶液应呈现粉红色,否则说明实验近乎失败;
(4)趁A烧杯中反应进行的时候,称取15.0gNH4HCO3固体于一100ml的C烧杯中,加入约55ml蒸馏水配制成NH4HCO3的饱和溶液待用;
(5)将A烧杯内的混合物质进行抽虑操作得到淡淡玫瑰红的溶液至于一150ml的D烧杯中;
(6)用胶头滴管吸取C烧杯中的NH4HCO3的饱和溶液逐滴加入到D烧杯中,直至D烧杯中不再有沉淀生成,另加过量1mlNH4HCO3溶液(用胶头滴管来量14滴左右);
(7)静置溶液,以待溶液中的MnCO3能够沉淀完全,再进行第二次抽虑操作,得到MnCO3沉淀,并用蒸馏水洗涤3~5遍得到较纯净的MnCO3沉淀;
(8)用洁净的药匙将得到的MnCO3沉淀从滤纸上轻轻刮下置于表面皿中,再置于50~60摄氏度的烘箱中烘烤约30~60min,这样就得到了较干燥的MnCO3粉末,其颜色应该呈现玫瑰红色的。2
本词条内容贡献者为:
唐浩宇 - 教授 - 湘潭大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国