艾滋病疫苗,即艾滋病病毒(HIV)疫苗,注射了它便可以在一段时间内防止艾滋病(类似乙肝疫苗的原理)。HIV疫苗被认为是预防艾滋病的最有效工具。HIV(艾滋病病毒)为逆转录病毒,而逆转录酶缺乏校正修复功能,因而HIV的变异频率非常高。
直到21世纪还没有针对HIV的特效治疗方法,用于治疗HIV感染的药物只能控制病毒复制,不能彻底清除病毒。因此,研制安全、有效的疫苗是控制HIV传播的重要手段之一。HIV易感者通过接种艾滋病疫苗,发生免疫反应,从而产生对疾病的特异抵抗力,提高免疫水平,达到预防和治疗HIV的目的。
疫苗疫苗是一种生物制品,是指用微生物或其毒素、酶、人或动物的血清、细胞等制备的供预防、诊断和治疗用的制剂。HIV疫苗包括HIV灭活疫苗、HIV减毒活疫苗、亚单位疫苗、活载体病毒蛋白疫苗、DNA疫苗等。
灭活和减毒活疫苗
HIV灭活疫苗和HIV减毒活疫苗
在很多传染病的预防工作中,都采用了针对病原体的灭活疫苗或减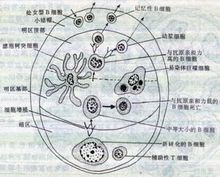 毒活疫苗来实现预防疾病感染的目的,因为此类疫苗能够模仿具有生物活性的病毒,将整个病毒颗粒呈递给免疫系统,能引起广泛的免疫影响。科学家们曾试图用同样的方法来预防HIV感染。一些试验结果亦证明:这种疫苗注入体内,可使病人血清HIV抗原转阴,减慢疾病进展速度。但有人对这种疫苗的安全性表示怀疑,担心这种疫苗引起感染,造成不良后果。有研究表明: 用一株自然减毒的猴免疫缺陷病毒(SHIV)活毒株接种猕猴可以阻止毒性SIV毒株在成年和新生猕猴中致病,但不能预防病毒感染。至今难以证实HIV灭活疫苗能否有效的诱导机体产生细胞免疫应答。许多研究人员希望通过删除对HIV的复制必不可少的基因来制备其变异缺陷株,使其在引起强烈免疫反应的同时又不会使人患上艾滋病,但还没有取得有效的研究成果。
毒活疫苗来实现预防疾病感染的目的,因为此类疫苗能够模仿具有生物活性的病毒,将整个病毒颗粒呈递给免疫系统,能引起广泛的免疫影响。科学家们曾试图用同样的方法来预防HIV感染。一些试验结果亦证明:这种疫苗注入体内,可使病人血清HIV抗原转阴,减慢疾病进展速度。但有人对这种疫苗的安全性表示怀疑,担心这种疫苗引起感染,造成不良后果。有研究表明: 用一株自然减毒的猴免疫缺陷病毒(SHIV)活毒株接种猕猴可以阻止毒性SIV毒株在成年和新生猕猴中致病,但不能预防病毒感染。至今难以证实HIV灭活疫苗能否有效的诱导机体产生细胞免疫应答。许多研究人员希望通过删除对HIV的复制必不可少的基因来制备其变异缺陷株,使其在引起强烈免疫反应的同时又不会使人患上艾滋病,但还没有取得有效的研究成果。
亚单位疫苗
亚单位疫苗即重组的病毒膜蛋白单体或多肽。由一种或一种以上HIV蛋白的非传染性颗粒构成,有包装的逆转录病毒核酸序列,故安全性良好。美国Vax Gen公司研制的重组gp120蛋白疫苗是唯一已进入人体Ⅲ期临床试验的HIV-1疫苗。但该疫苗由于是单体重组蛋白,刺激产生的中和抗体谱较窄,抗 HIV-1野生株的攻击力有限。因此,为了提高该类疫苗的保护能力,需要继续研制接近天然HIV-1的重组糖蛋白以及近一步了解膜蛋白结构及免疫侵入机制。
活载体病毒蛋白疫苗
将编码病毒蛋白的基因插入其他活病毒或细胞基因组中并用之感染动物或人体,使外源基因在宿主细胞表达,可产生对基因产物及载体的免疫应答。活病毒载体包括痘苗病毒、杆状病毒和腺病毒等。研究较多的是痘病毒疫苗。痘病毒疫苗在感染宿主细胞胞浆中复制,无致癌性,此类疫苗可诱导机体产生细胞免疫和体液免疫且疫苗易于生产和保存。但对其安全性问题仍应加以关注。HIV感染导致机体免疫抑制,若载体在体内变异,威胁患者本身的生命。已报道进入Ⅱ期临床试验的金丝雀痘病毒载体疫苗被证明可产生持久的体液免疫和细胞免疫应答。因鸟类痘病毒在人的细胞中没有完整的复制周期,所以其安全性相对较好。
DNA疫苗
DNA疫苗被称为继完整病原体疫苗和基因工程重组蛋白疫苗之后的第3代疫苗,即将插入并表达目的抗原基因之质粒DNA经各种转移途径转入机体细胞,借用宿主细胞的表达加工合成抗原分子。1992年,Tang 等首先经鼠皮肤直接接种编码外源蛋白的质粒DNA,发现这种免疫方式也能使机体产生抗体应答,证实“裸”DNA可以通过抗原表达作为免疫原。裸露的质粒 DNA注入机体后,可以进入细胞并持续表达外源蛋白,从而有效地激发体液免疫和细胞免疫。它们在猕猴试验上的有效性已经得到证实,通常可以阻止SIV引起的AIDS。通过这种直接体内注射的方法,免疫用蛋白质的抗原表位以一种能被宿主受体自然识别的方式产生出来,抗原肽的呈递与自然感染相似,这一特性对于构象型抗原表位引起的保护性免疫尤为重要。这种疫苗兼有减毒活疫苗的有效性及亚单位疫苗的安全性,既像接种了活的病毒体一样可以不断表达抗原蛋白,又可方便的精选所需基因片段,激发理想的免疫应答。这种疫苗由于可以在机体细胞内表达抗原且具有较好的免疫原性,可诱导体液免疫应答和较强的细胞毒反应,同时它又可以制成多价疫苗,易于改造以适应于流行毒株,并且易于制备和保存,特别适合于发展中国家。基于以上种种优点,DNA疫苗是如今艾滋病疫苗研制的热点,且已有HIV 的DNA疫苗进入人体试验阶段。
研究意义艾滋病 艾滋病是一种全球性疾病,蔓延速度快,死亡率高。自1981年首次发现艾滋病以来,HIV的感染在世界范围内迅速流行。至2002年底世界上至少有193个国家和地区发现有HIV感染者死亡,且其仍以每天感染 15000人的速度快速扩展,其中95%以上的HIV感染者生活在发展中国家,中国HIV感染人数现已超过100万。已造成全球累计6000余万人感染,2000余万人死于AIDS,艾滋病在非洲是首要死亡病因,而在全球范围内则是第四大死亡病因。
艾滋病是一种全球性疾病,蔓延速度快,死亡率高。自1981年首次发现艾滋病以来,HIV的感染在世界范围内迅速流行。至2002年底世界上至少有193个国家和地区发现有HIV感染者死亡,且其仍以每天感染 15000人的速度快速扩展,其中95%以上的HIV感染者生活在发展中国家,中国HIV感染人数现已超过100万。已造成全球累计6000余万人感染,2000余万人死于AIDS,艾滋病在非洲是首要死亡病因,而在全球范围内则是第四大死亡病因。
当前治疗水平HIV/AIDS的流行对社会和经济产生了极大的负面影响。直到21世纪还没有针对HIV的特效治疗方法,虽然高效抗逆转录病毒的治疗方法(highly active antiretroviral therapy,HAART)已经在减轻患者痛苦、延长患者寿命等方面取得了一定的效果,但用于治疗HIV感染的药物只能控制病毒复制,不能彻底清除病毒,而且抗HIV药物价格昂贵,具有较严重的副作用,药物使用不当,也会诱发耐药株的产生。因此,研制安全、有效的疫苗是控制HIV传播的重要手段之一。HIV易感者通过接种艾滋病疫苗,发生免疫反应,从而产生对疾病的特异抵抗力,提高免疫水平,达到预防和治疗HIV的目的。
疫苗作用大多数经典疫苗的作用在于防止病原感染而发展成疾病,而不在于防止病原进入,但HIV 则不同,因为即使很小量的感染都会导致AIDS,所以要求疫苗能产生高效价的中和抗体并有效地记忆,以清除所有进入的病毒。以下几种现象表明艾滋病疫苗是可行的。首先,HIV病毒株大多是单一型,这就为疫苗诱导免疫反应提供了机会。另外,病毒有限制性结构和基因特征,从而可进一步改善保护免疫力的识别机制。来源于高暴露但未感染者和长期无进展的免疫反应显示HIV疫苗的可行性。在非人灵长类动物模型中有慢病毒感染受被动保护的例子同样证明HIV疫苗是可行的。
HIV感染迄今为止,全球HIV感染和AIDS日趋严重,抗HIV疫苗的研制也日益受到人们的重视,并取得了一些可喜的进展。如今在HIV疫苗研制中比较现实的目标是制备出的疫苗能在初始感染时降低其感染水平,并在以后能有效控制病毒复制水平,以减缓临床病程进展。随着人们对HIV的深入研究,HIV流行特点、流行株的克隆、测序和重配等基础工作的完成,以及HIV病毒本身生物学特性尤其是基因变异情况的阐明,将不断开发出新的更有效的疫苗,最终实现预防和治疗 AIDS的愿望。
疫苗命运命运多舛的HIV疫苗
最初,由VaxGen公司开发的疫苗AIDSVax,是HIV外膜糖蛋白gp120的重组体,虽然采用了乙肝 疫苗的成功经验,但是在志愿者中进行的试验表明,该疫苗不能预防感染的发生,显然,AIDSVax不能诱导产生广谱的中和抗体。还有一种组合疫苗,先给予基础剂量的vCP1521(一种重组的金丝雀痘病毒载体,SanofiPasteur公司开发),再同时给予加强剂量的病毒载体以及VaxGen公司的AIDSVax,从而可以既能诱导T细胞,又能诱导抗体的产生,这种疫苗目前正在泰国进行大规模的临床试验,其结果有望在2009 年底公布。
疫苗的成功经验,但是在志愿者中进行的试验表明,该疫苗不能预防感染的发生,显然,AIDSVax不能诱导产生广谱的中和抗体。还有一种组合疫苗,先给予基础剂量的vCP1521(一种重组的金丝雀痘病毒载体,SanofiPasteur公司开发),再同时给予加强剂量的病毒载体以及VaxGen公司的AIDSVax,从而可以既能诱导T细胞,又能诱导抗体的产生,这种疫苗目前正在泰国进行大规模的临床试验,其结果有望在2009 年底公布。
一种成功的疫苗,应该能同时诱导产生广谱的中和抗体以及细胞毒性T淋巴细胞。由于前者还存在很大的困难,所以有几种研发中的疫苗是诱导细胞毒性T淋巴细胞的。在非人类的灵长类动物模型中发现,这类的疫苗虽然不能预防感染,但是能控制病毒的水平,减少早期胃肠道相关淋巴组织中CD4+T细胞的破坏,并延缓疾病的进展。此外,如果人类在HIV暴露之前就接种该疫苗,可能能够减低感染的程度,因为疫苗能够降低病毒的水平,而且,二代传播的风险也可能会降低。但是有几点必须注意。
首先,“T细胞疫苗”是否对人类的HIV有作用,尚未得到证明。到目前为止,只有一种T细胞疫苗进行过人体试验,即Merck公司的MRKAd5HIV-1(gag、pol、nef)三价疫苗。共进行了两项临床研究,第一项是STEP研究(临床试验注册号:NCT00095576),是在北美、南美、加勒比海和澳大利亚进行的;第二项是Phambili研究(NCT00413725),在南非进行的。由于STEP研究的数据表明,该三价疫苗不能预防HIV感染,也不能降低接种疫苗的志愿者感染HIV后的病毒水平,所以两项研究均不得不提前中止。出乎意料的是,对STEP研究中的数据进行析因分析还发现,接种疫苗者新发HIV感染甚至还高于安慰剂组。接种者当中,HIV感染的相对风险最高的,是在入组时未割过包皮,而且先天性获得了病毒载体——腺病毒5的中和抗体的男性,而入组时割过包皮、没有产生腺病毒5中和抗体的,其HIV感染风险则没有明显的增加。
此外,T细胞疫苗的免疫反应还因人而异,可能与HLA单倍型有明显的关联。因此,T细胞疫苗可能增强人体对HIV的自然免疫反应,而这要取决于个体的HIV单倍型。换句话说,此类的疫苗只对有“有利”HLA单倍型的个体有效。
第三,传统的病毒疫苗,比如脊髓灰质炎、天花、麻疹,能够保护接种者不发生感染,完全清除病毒,而且保护作用能够一直持续。在人群中广泛接种,可以减少感染人群的数量以及感染的传播率。即使只在易感人群中接种,也能大大降低感染的传播,这就是疫苗的群体保护效应。但是,HIV的T细胞疫苗不能预防感染,只能通过减低病毒的水平来延缓疾病的进展,那么虽然二代传播的风险会降低,但不会阻断。而且病毒复制在一定水平上仍然存在,HIV不可避免地会发生变异,从而最终仍会逃脱免疫的控制,增加二代传播的风险。所以,任何一种T细胞疫苗的群体保护效应都是短暂的。
第一个T细胞疫苗在控制感染风险或病毒水平方面的失败,迫使HIV疫苗的研发不得不重新寻找方向。
研制成功希望渺茫
2008 年03月03日据英国广播公司报道,HIV(艾滋病病毒)疫苗的研制工作已经有20年历史了,虽然科学家为此付出了艰辛的努力,但这个世人渴望的疫苗却迟迟不愿上场。甚至有科学家称,疫苗研制成功的希望“非常渺茫”。在参与疫苗研制工作中的所有科学家中,美国科学促进协会会长大卫·巴尔的摩教授充当了一个领头羊角色。巴尔的摩在接受媒体采访时向人们传递了一个令人沮丧的消息。他表示,虽然一直在努力,但研制成功的希望却“非常渺茫”。 “1984年,我们被告知这样一种观点:既然已经发现了这种病毒,那对抗它的疫苗一定就躲藏在角落里。然而,与发现这种病毒时相比,我们几乎没有向前前进一步。”
行进中的疫苗开发
人体为何不能在自然感染期间产生广谱的中和抗体,如果能够回答这一问题,将有助于开发有效的疫苗,诱导产生相应的抗体。而且,通过疫苗诱导的免疫反应必须要比自然感染诱导的免疫反应更为强效。单克隆抗体,也具备广谱中和抗体的作用,虽然非常少,到21世纪为止还无法获得,但是诱导单克隆抗体这一途径对开发HIV疫苗可能是行之有效的。此外,研究者通过X线结晶技术发现了HIV是如何利用CD4受体进入细胞内的,以及广谱中和抗体是如何结合于CD4的结合部位来有效中和HIV的,这一发现将有助于HIV疫苗的开发。
研究HIV包膜蛋白的三聚体结构是21世纪的一个研究热点,有望得出一些新的研究思路。还有一个思路是,设计一种新型的包膜抗原,也就是在HIV的包膜蛋白上加上一个支架蛋白,从而可以保证HIV能够被免疫系统识别并产生抗体。
通过诱导广谱反应性细胞毒性T淋巴细胞和中和抗体开发的疫苗是不会有用的,除非这种疫苗所产生的效应,能够在病毒潜伏下来之前这段非常短的时间窗内就能将其消灭。更加深入的了解HIV感染早期的机制,将会有助于阐明先天性免疫应答以及粘膜免疫应答在控制HIV感染中的作用,以及如何对这些作用进行调控,以拓宽根除病毒的时间窗,防止HIV进入胃肠道的淋巴组织。
人们可能无法开发出传统意义上成功的HIV疫苗,因为有很多的科学难题需要解决。为了解决这些障碍和难题,科学家们必须再回到基础研究中去,进行一些更深入、到21世纪为止疫苗开发中还未探讨过的研究。对于HIV疫苗的开发,还要保持谨慎的乐观态度,必须还要进行大量的基础研究。
国内研究组织中国艾滋病疫苗联盟
2009年3月,中国艾滋病疫苗联盟(CAVI)在北京召开的第一届中国艾滋病疫苗论坛上正式成立。该联盟由中国国内从事艾滋病疫苗研究的几十家研发单位自发组成,是中国第一个艾滋病疫苗研究组织。
在随后举行的亚洲艾滋病疫苗区域协商会议上,CAVI的发起人之一、中国疾病预防控制中心艾滋病首席专家邵一鸣向《科学时报》记者介绍道:“艾滋病疫苗的研制是一项艰巨的系统工程,不能仅仅依靠个别研究团队在短时期内解决,要想有所作为,必须加强合作。CAVI就是中国疫苗研究队伍团结在国家重大科技专项的旗帜下,开展协同攻关和参与国际合作的最佳平台。”
亚洲艾滋疫苗区域协会
亚洲艾滋病疫苗区域协商会议由世界卫生组织、联合国艾滋病规划署、全球艾滋病疫苗企业计划、美国国立卫生研究院艾滋病研究办公室和中国疾控中心共同举办。中国科学院院士曾毅向《科学时报》记者介绍,国际发达国家都有各种艾滋病研究组织,同时又有全球性组织。他认为CAVI的成立一方面能够联合国内科学家,同时也有助于加强国际交流。
系列问题
尽管中国的艾滋病疫苗研究具有一定实力,但也存在一系列问题,如创新研究少、重复研究多、单一团队研究多、合作攻关少、上游研发和下游开发脱节等,尚未形成国际上出现的大型联合团队。CAVI正是为了应对这些情况而成立的。据介绍,CAVI联合了“十一五”规划的重大科技专项中所支持的4个课题组和2个研究平台,基本覆盖了中国研发艾滋病疫苗的主要科研人员。中国药品生物制品检定所细胞室主任王佑春向《科学时报》记者介绍,联盟成立的目的,是确定今后中国艾滋病疫苗研制的发展方向,整合资源、减少重复性工作、开展创新性研究。他表示,联盟还将建立起客观统一的评价方法、管理方法和共享机制,保证国家经费的投入能够获得更好的效果。
临床实验 2009年03月21日,中国食品药品监督管理局宣布,由中国自行研制的预防性艾滋病疫苗正式进入二期临床实验,这是中国第一次在高危人群中,对艾滋病疫苗进行安全性的评价和有效性的探索。
2009年03月21日,中国食品药品监督管理局宣布,由中国自行研制的预防性艾滋病疫苗正式进入二期临床实验,这是中国第一次在高危人群中,对艾滋病疫苗进行安全性的评价和有效性的探索。
该批准进入二期临床实验的预防性艾滋病疫苗,是来自吉林大学、长春百克药业有限责任公司、中国药品生物制品检定所、广西壮族自治区疾病预防控制中心等单位科研人员从1996年开始着手研究的。一期临床实验从2005年3月12日开始,在广西进行,共有49名志愿者接受了疫苗的注射。二期临床实验仍在广西进行,将有230名志愿者在知情同意、保护受试者合法权益的情况下,开展一系列实验研究。
中国国家食品药品监督管理局新闻发言人颜江瑛表示,一期临床实验主要是在健康人群中探索艾滋病疫苗的安全性。一期实验结果表明,在小范围的健康人群中,我国自行研制的疫苗是安全的。二期临床实验主要是在高危的健康人群当中进一步探索它的安全性,同时,初步探索它的有效性。
颜江瑛强调,艾滋病疫苗研究是一个长期的过程,到21世纪为止还不能表明我们有成功的疫苗了,“什么时候能够运用到病患者身上,还有很长的路要走。”科研人员将根据这次人体实验结果,考虑是否进入三期临床实验,三期临床实验主要是在更大范围的人群中,评价疫苗的有效性。
2011年3月2日,长春高新公告称,公司下属控股制药企业长春百克药业有限责任公司申报的治疗类艾滋病疫苗项目,已经正式收到国家食品药品监督管理局出具的《药物临床试验批件》,批准进入I 期临床试验
最新动态艾滋病疫苗研究曙光乍现?克莱尔·托马斯(ClareThomas)关于艾滋病疫苗前景的悲观判断似乎遇到了挑战。这位《自然-医学》杂志的资深编辑在采访了25位权威艾滋病专家后,得出“艾滋病有效疫苗似乎在未来10至15年内不会被发现”的结论,这一观点发表在2009年8月的《自然-医学》杂志上。
挑战这一观点的,是源自正在泰国进行的一项新型艾滋病疫苗临床试验的新进展。9月24日,美国和泰国研究人员在泰国首都曼谷联合宣布,一种新型试验疫苗可使人体感染艾滋病病毒的风险降低31.2%。这是研究人员在泰国选取1.6万多名志愿者经过6年测试后得出的结果。
宛如黑夜中擦亮的一丝火花,这一结果让全世界的艾滋病研究者感到振奋。美联社报道称,这是全球第一种确认有一定免疫效果的疫苗,这让人们重新看到未来艾滋病疫苗研究的希望。
但是,这丝火花能否燃烧成引领艾滋病疫苗走出黑暗的火炬?
同日,世界卫生组织和联合国艾滋病规划署发表联合声明,在肯定这一试验结果的“重大意义”的同时,冷静地表示,“仅仅基于目前的试验结果,还不能批准生产这种疫苗”,人类战胜艾滋病的道路依然漫长。
这项名为RV144的项目,由美国军方、泰国公共卫生部等机构联手从2003年开始实施。自2007年9月美国默克公司全球艾滋病疫苗人体试验失败之后,该项目成为全世界惟一一项万人以上参与的大规模艾滋病疫苗临床试验。
该试验的研究策略建立在之前两个失败的艾滋病疫苗研究基础上。2003年,数十名科学家对研制出的两种艾滋病疫苗ALVAC和AIDSVAX分别进行了大规模的早期测试,结果两种疫苗均未起到免疫作用,试验宣告失败。 随后,美国和泰国的研究者把两种失败疫苗的联合作为新的研究方式,采用“初免-增强”(Prime-Boost)免疫策略,让第一株疫苗ALVAC负责刺激免疫系统,使其做好攻击艾滋病病毒的准备,第二株疫苗AIDSVAX则加强攻击力度,负责增强免疫发应。RV144试验正式开始于2003年10月,试验对象是在泰国选取的1.6万多名年龄在18岁至30岁的志愿者。其艾滋病病毒检测均为阴性,且其感染风险与普通人群的平均水平相当。其中,一组志愿者被注射了联合疫苗,另一对照组则只被注射了安慰剂。
最新的结果显示,在8197名接受疫苗注射的志愿者中,51人感染了艾滋病病毒,而在对照组的8198人中,有74人感染,也就是说,注射疫苗组感染风险降低了31.2%。
美国陆军军医处处长埃里克斯·库梅克说,这是“第一个备选艾滋病疫苗成功减少艾滋病感染危险”的实例。
世界卫生组织和联合国艾滋病规划署9月24日发表联合声明表示,由美国和泰国联合开发试验的新型艾滋病疫苗获得的结果“令人鼓舞”。“虽然免疫效果有限,但在统计学上显示出降低艾滋病病毒感染风险的重要意义。”法国赛诺菲-巴斯德公司研发副总裁米歇尔·德维尔德说,“自从1983年发现艾滋病病毒以来,这是科学界首次获得具体证据证明,研发艾滋病疫苗是可行的。”参与该研究的美国国家过敏和传染病研究所所长安东尼·福奇(AnthonyFauci)审慎地表示,这并非“艾滋病疫苗研究的终点”。包括联合国艾滋病规划署、世界卫生组织等机构也都表示“谨慎的乐观”。
路透社的报道指出,这种疫苗的局限还在于,如果人们已经感染上了艾滋病毒,即使接种了疫苗,病毒对免疫系统的破坏同样严重,这意味着一旦病毒进入体内,疫苗根本没有作用。
一系列针对新疫苗的基础研究尚未有结论。比如,针对不同的艾滋病病毒,针对不同人群,新型疫苗是否都有相同的免疫效果?新型疫苗的有效免疫期有多久?新型疫苗为何只表现出十分有限的免疫效果?
据悉,这项试验的具体情况将在巴黎10月召开的疫苗会议上得到进一步披露。
泰国艾滋病疫苗研究的进展,也为中国在此领域的研究带来了希望。据了解,由国家食品药品监督管理局正式批准,我国自行研制的艾滋病疫苗已经在广西正式进入Ⅱ期临床试验。
2011年加拿大首个艾滋病疫苗获准开展人体试验
2011年末,来自加拿大西安大略大学的研究人员表示,他们已经研究出了一种艾滋病病毒疫苗,利用基因改造技术制成的预防艾滋病全病毒灭活疫苗;与其他的疫苗不同,它使用到了整个艾滋病毒,而非其中的某一段基因或蛋白质。
病毒在基因层次上已经被改造成“非病原性的”,这意味着它不可能使受试者感染上艾滋病。研究人员的想法是用疫苗使T细胞有所准备,使其能够摧毁任何被艾滋病病毒感染的细胞。
到目前为止,在对实验室动物的初步毒理学试验中,该疫苗已经能够刺激产生很强的免疫反应。但是研究人员仍需要数年时间来知道它是否对人类也有效果。
目前美国食品和药物管理局(FDA)已经准许研究组来对人类进行实验性疫苗测试。第一阶段的临床测试已于2012年1月份进行,测试对象为40名艾滋病病毒携带者。这一阶段将检测疫苗的安全性。如果一切正常,那么下一阶段的研究将会检测是否疫苗确有其效。第二阶段将对艾滋病检测为阴性的自愿者测试疫苗的免疫反应。第三阶段则会在大约6000名具有受艾滋病感染的风险的人群中测试疫苗的效果。其中一半试验者给予疫苗,另一半则作为安慰剂对照组。参与者将被跟踪3年,最后观察到底有多少人感染上了病毒。
该疫苗名为“SAV001”,由康池永(Chil-Yong Kang)博士和他的小组历时10年研发而成,同时它也是加拿大目前唯一正在进行研究的艾滋病病毒疫苗。目前在美国的第一阶段临床实验取得良好进展,研究人员正在分析现阶段的实验结果,为下一阶段的实验做准备。1
2012年新进展2012年3月6日2,古巴专家在哈瓦那宣布,古巴研制的艾滋病疫苗已在老鼠身上试验成功,并将转入人体试验。
研究小组负责人恩里克·伊格莱西亚斯在这里召开的第29届生物技术国际会议上向来自38个国家的600多名与会代表介绍古巴这一成果时说,他领导的小组研制的艾滋病疫苗名为HIV-1治疗型疫苗,是以一种重组蛋白质为基础,依靠遗传工程技术研制成功的,疫苗寻求使肌体细胞对艾滋病病毒产生反应。
这种疫苗在老鼠身上的试验已获得成功,将于转入人体试验。人体试验初期规模将“很小,并受到严密的监控”,试验对象为“感染病毒初期”、“抗体呈阳性”的患者。
古巴全国约有1.54万艾滋病病毒感染者,为世界上感染病毒最少的国家之一。自1986年发现首例艾滋病患者以来,古巴已有2580人死于此病。古巴卫生部官员说,古巴每年都拨款2亿多美元,用于艾滋病的预防和宣传以及艾滋病患者的治疗。
“艾滋末日”指日可待原题:南非试验唯一部分有效疫苗:艾滋末日或可期
中新社北京6月21日电 南非德班消息:研究人员在21日闭幕的南非第六届艾滋病大会上宣布:世界上唯一被证明部分有效的艾滋病疫苗,已在南非展开试验。当地媒体认为,这也意味着“艾滋末日”指日可待。
南非《星期日泰晤士报》称,这个研究项目以祖鲁语命名为“乌哈姆波”,意即“旅程”。项目负责人为威特沃特斯兰德大学的格伦达·格雷博士。整个项目为期10年,耗资总额达1.25亿美元。这个项目是“许可研究”,一旦成功,疫苗将会投入市场使用。
艾滋病在1983年一经发现,被称为是“世纪瘟疫”。科学家们认为,疫苗是预防艾滋病的最便捷和最有效的方法,可能是其唯一终结者。截至2010年,全世界共开展约190项艾滋病疫苗试验。其中,中国的预防型疫苗研究也已进入II期临床试验阶段。
此次在南非进行试验的RV144疫苗已经过20多年的研制。“艾滋疫苗试验网络”发言人詹姆斯·梅纳德介绍说:“这是迄今对人类免疫缺陷病毒(HIV)唯一部分有效的疫苗,2009年曾在泰国进行过试验。下一次大规模的艾滋疫苗测试,将在南非展开。”
几年前美国和泰国研究人员联手进行RV144疫苗试验,这种疫苗能够帮助部分人避免感染,但有效性只有31.2%,未能获得泰国政府的投产许可。在“艾滋病疫苗倡导联盟”负责人米切尔·沃伦看来,一种艾滋疫苗要正式投入使用,有效性至少须达到50%到60%。
南非广播公司报道称,该项目将首先在南非募集100名HIV呈阴性的志愿者参加试验,研究人员将判定疫苗对南非C株病毒的有效性是否与在泰国时一样。如果有效,从2016年起,他们希望能有数以千计的志愿者参加试验。到2019年,研究人员希望能拿出一些理想的研究成果。
项目负责人格雷介绍说,研究人员将试图让这种疫苗在人体内的生存时间更长,并能有更好的预防作用。美国和泰国研究人员12年曾宣布,他们又发现了艾滋病病毒外壳上一个易被攻破的弱点,这能够解释之前疫苗的有效性问题。即便如此,格雷并不指望这种疫苗能一劳永逸:“我们至今只有不完善的疫苗预防,这需要和男性包皮环切术,以及抗逆转录病毒药物等一起来防范。”
世界卫生组织的资料显示,艾滋病过去30多年已造成全球2500多万人死亡。2011年,约有3400万人携带艾滋病毒,其中有将近600万人在南非。3
HIV疫苗取得突破调查显示,在没有接受抗病毒治疗的前提下,有 1% 的艾滋病感染者可以顽强的生存下来,这是因为他们的免疫系统会产生的特定的 HIV 抗体,它们可以识别病毒表面蛋白质特征,自行绑定并且消灭体内的艾滋病病毒。研究细胞表面蛋白质的技术荧光激活细胞分选术(FACS)也可以用来研究病毒,取得一部分细胞样本,加入荧光抗体,并绑定你感兴趣的蛋白质。带有被抗体识别出的蛋白质的细胞也会变成荧光,而缺乏这种蛋白质的细胞则不会。
接着就可以分别测量每一个细胞的荧光性,并把它们分离到培养皿中。FACS 对于大型病毒的测量是非常准确的,比如埃博拉;但是对于精细病毒的测量,比如艾滋病病毒却存在着一定的局限性。这也是艾滋病疫苗难以成功的关键。
日前,来自法国的研究团队开发出一种快速排序 HIV 病毒的新科技,有望助力 HIV 疫苗的快速问世,完整的研究报表发表于《细胞化学生物》杂志中。
研究人员表示:“我们开发了一种系统,使我们能够以每秒数以百计的速度分析艾滋病病毒, 并根据其表面蛋白的功能分离病毒,我们没有使用可以直接绑定蛋白的荧光抗体,相反,我们使用了普通的,非荧光抗体连接碱性磷酸酶(AP),然后我们附上单独的病毒滴液体,碱性磷酸酶会在滴液内部产生大量荧光分子,从而创建一个强大的荧光信号。如果蛋白质没有特定的性质,抗体碱性磷酸酶将不会将其绑定。通过这种方法,我们可以研究单个病毒,有助于 HIV 疫苗的开发进程。”
我们是一个微流体系统—换句话说,就是使用操纵极少量的液体的技术,整个系统包含在微流控芯片上,一个由液体流过的微观网络渠道组成的巴掌大小的设备。这些渠道只有百分之几毫米宽,我们的实验所用滴液 30/1000000000 毫升左右。微流控芯片工作时,提供与艾滋病毒等病原体接触的特定优势,它们完全密封,因此使用起来非常安全。典型的流式细胞仪系统可以产生飞沫,所以更需要严格的控制措施来处理有害的细菌和病毒。
“我们的方法分析 HIV 病毒的数量和速度是前所未有的,这使我们能够快速测试数以百万计的病毒变异,大大加快疫苗研发的过程。”
“在我们的试验中,每一滴滴液都包含病毒和抗体,接下来,我们还可以把细胞也加入滴液中,观察抗体是否可以阻止病毒进入细胞之中,而这一切都是荧光激活细胞分选术不可能达到和完成的,我们相信此次试验为未来的研究提供了更多更大的可能性,为艾滋病疫苗的提前问世带来了绝对的可能性。”4





 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国