概念
在只有一个步骤(即电子转移步骤)的电极反应中,人们可以用下式把电化学反应速率常数与它的“化学”对应数(可逆电位下的速率常数)联系起来: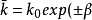 η
η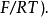
系数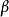 就称为对称因子,其值接近1/2,但正、逆反应的
就称为对称因子,其值接近1/2,但正、逆反应的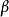 值可有所不同。
值可有所不同。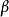 与位能-距离分布图中反应物和产物所在点的梯度有关。如果靠近交点的斜率对产物为
与位能-距离分布图中反应物和产物所在点的梯度有关。如果靠近交点的斜率对产物为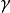 、对反应物为
、对反应物为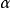 ,则
,则
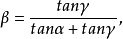 博克里斯首先发表了上式的几何证明。后来马库斯在没有参考前人工作的情况下也得出了上述关系式。1
博克里斯首先发表了上式的几何证明。后来马库斯在没有参考前人工作的情况下也得出了上述关系式。1
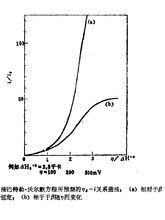
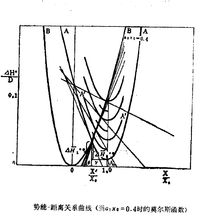
对称因子随电位的变化为了确定对称因子对电位的影响,有必要在更负的电位下工作,此时电位对势垒形状的影响是显著的。这项工作在1960年是首先由德斯皮克和博克里斯完成的。他们为了确定上述影响,选择了银沉淀反应,并且通过在高过电位和非常短时间下工作,避免了迁移的影响,从而得以画出考虑对称因子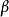 随过电位η而变化的
随过电位η而变化的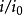 曲线图(如图1)。
曲线图(如图1)。
对称因子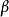 借助莫尔斯参数随过电位η而变化的理论同近代某些人所采用的非谐性较正方法相比,是一种更普遍的理论方法。按照德斯皮克和博克里斯的作法,方程可推导如下。
借助莫尔斯参数随过电位η而变化的理论同近代某些人所采用的非谐性较正方法相比,是一种更普遍的理论方法。按照德斯皮克和博克里斯的作法,方程可推导如下。
分别为溶剂化离子和吸附离子所固有的曲线AA和BB(如图2)可用方程表示:
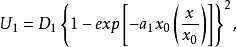
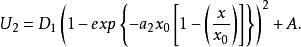 于是:
于是:

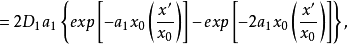
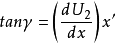
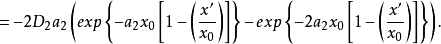
根据上面两个方程,可得:
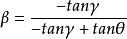
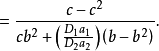 式中,
式中,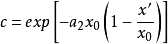 ,而
,而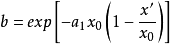 。因为在交叉点处
。因为在交叉点处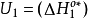 且
且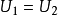 ,故
,故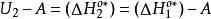 ,则方程
,则方程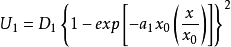 和
和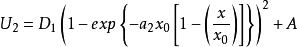 可重新写作
可重新写作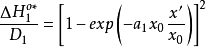 和
和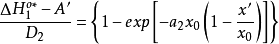 。
。
关于对称因子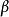 随电位而变化的其他工作一直是有限的,帕森斯和帕瑟朗的工作是按连续介质的静电近似来解释的,然而,根据这种解释,其
随电位而变化的其他工作一直是有限的,帕森斯和帕瑟朗的工作是按连续介质的静电近似来解释的,然而,根据这种解释,其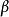 值理应随过电位而连续变化。2
值理应随过电位而连续变化。2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国