青蒿素是从复合花序植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物,由中国药学家屠呦呦在1971年发现。1分子式为C15H22O5。
青蒿素是继乙氨嘧啶、氯喹、伯喹之后最有效的抗疟特效药,尤其是对于脑型疟疾和抗氯喹疟疾,具有速效和低毒的特点。
研究历史疟疾是危害严重的世界性流行病,全球百余国家年约三 亿多人感染疟疾。1964年,越南战争爆发,当时北越军队常出没于山间丛林地区,而这一地区恶性疟疾流行猖獗,且对奎宁及奎诺酮类抗疟药物如氯喹(chloroquine)等普遍出现了耐药性,平民与军队的患病人数猛增,越南政府请求支援。中国政府于1967年5月23日在北京成立5·23抗疟计划办公室,统一领导《5·23 抗疟计划》的实施,其全称为中国疟疾研究协作项,代号为"523"。领导小组由国家科委(正组长)、总后勤部(副组长)、国防科委、卫生部、化工部、中国科学院各派一名代表组成,直接归国家科委领导。办事机构以中国人民解放军后字236部队为主(推测为军事医学科学院代号),办公室设在后字236部队。不过,由于进展和当时的政治环境,"523"领导小组曾多次发生变动,如1971年5月22日广州召开的全国疟疾防治研究工作座谈会上,领导小组改为由卫生部(正组长)、总后卫生部(副组长)、化工部和中国科学院组成。后来,一位研究人员曾调侃,正是由于这一项目,“使得在当时到处停工的医药研究单位留下了一支队伍”。234
亿多人感染疟疾。1964年,越南战争爆发,当时北越军队常出没于山间丛林地区,而这一地区恶性疟疾流行猖獗,且对奎宁及奎诺酮类抗疟药物如氯喹(chloroquine)等普遍出现了耐药性,平民与军队的患病人数猛增,越南政府请求支援。中国政府于1967年5月23日在北京成立5·23抗疟计划办公室,统一领导《5·23 抗疟计划》的实施,其全称为中国疟疾研究协作项,代号为"523"。领导小组由国家科委(正组长)、总后勤部(副组长)、国防科委、卫生部、化工部、中国科学院各派一名代表组成,直接归国家科委领导。办事机构以中国人民解放军后字236部队为主(推测为军事医学科学院代号),办公室设在后字236部队。不过,由于进展和当时的政治环境,"523"领导小组曾多次发生变动,如1971年5月22日广州召开的全国疟疾防治研究工作座谈会上,领导小组改为由卫生部(正组长)、总后卫生部(副组长)、化工部和中国科学院组成。后来,一位研究人员曾调侃,正是由于这一项目,“使得在当时到处停工的医药研究单位留下了一支队伍”。234
1969年,在军事医学科学院驻卫生部中医研究院军代表的建议下,全国“"523"办公室”邀请北京中药所加入“"523"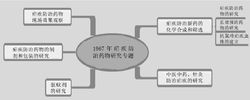 任务”的“中医中药专业组”。北京中药所指定化学研究室的屠呦呦担任组长。当时的基本思路是采取民间验方,然后利用现代的有机溶剂分离药用部位并进行相应的药理筛选和临床验证,研究人员整理了多达808种可能的中药。据称她们开始并未考虑使用青蒿,因为它的抑制率极不稳定,12-80%,直至看到东晋葛洪《肘后备急方》中将青蒿“绞汁”用药,从而得到启发,以现代科学组织筛选,改用乙醚提取。1971年10月,青蒿的动物效价由30%~40%提高到95%。1971年12月下旬,用乙醚提取物与中性部分分别对感染伯氏疟原虫 (Plasmodium berghei) 小鼠以及感染猴疟原虫(Plasmodium cyomolgi) 猴的疟原虫血症(parasitemia) 显示 100%的疗效。567
任务”的“中医中药专业组”。北京中药所指定化学研究室的屠呦呦担任组长。当时的基本思路是采取民间验方,然后利用现代的有机溶剂分离药用部位并进行相应的药理筛选和临床验证,研究人员整理了多达808种可能的中药。据称她们开始并未考虑使用青蒿,因为它的抑制率极不稳定,12-80%,直至看到东晋葛洪《肘后备急方》中将青蒿“绞汁”用药,从而得到启发,以现代科学组织筛选,改用乙醚提取。1971年10月,青蒿的动物效价由30%~40%提高到95%。1971年12月下旬,用乙醚提取物与中性部分分别对感染伯氏疟原虫 (Plasmodium berghei) 小鼠以及感染猴疟原虫(Plasmodium cyomolgi) 猴的疟原虫血症(parasitemia) 显示 100%的疗效。567
1972年初抗疟有效单体从植物青蒿中分离得到,当时的代号为“结晶Ⅱ”,后改名为“青蒿Ⅱ”,最后定名为青蒿素。1972年3月8日,《用毛泽东思想指导发掘抗疟中草药工作》的报告在"523"计划内部会议上发布。效果虽好,但在批量生产时相关药厂不愿意承担提取药品任务,使得项目组只好把实验室当成了生产车间,而由于乙醚易燃,结果在屠呦呦作报告的当日,由于操作人员不慎而引发大火,这一事故差点使得计划夭折。89
由于计划时间进度紧张,为了尽早应用于临床,1972年5月计划部分相关研究人员(包括屠呦呦)用自身进行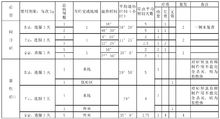 人体试验并获得通过,8月在海南部分地区进行临床试验,在选试的 21 例疟疾患者中, 感染恶性疟或间日疟(subtertian or tertian malaria)者各占半数. 经治疗后, 患者的发热症状可迅速消失, 血中疟原虫的数目锐减;而接受氯喹的对照组患者则无效(个别数据存在争议,也有个别参与人员回忆年份为1973年)。1011
人体试验并获得通过,8月在海南部分地区进行临床试验,在选试的 21 例疟疾患者中, 感染恶性疟或间日疟(subtertian or tertian malaria)者各占半数. 经治疗后, 患者的发热症状可迅速消失, 血中疟原虫的数目锐减;而接受氯喹的对照组患者则无效(个别数据存在争议,也有个别参与人员回忆年份为1973年)。1011
1975年,由北京中药所和上海有机所借助国内不多的几台大型仪器确定了青蒿素的分子式,年底通过单晶X射线衍射分析确定其分子结构,1978年由反常散射的X射线衍射分析确定了青蒿素的绝对构型。
1977和1979年,青蒿素的研究成果在中国《科学通报》与《化学学报》上发表,同年青蒿素的分子式被美国《化学文摘》收录。1213
1979年9月,依国家医药管理总局建议,"523"计划列入各级民用医药科研计划之中,不再另列医药军工科研项目。1981年3月3日-3月6日,"523"计划举行最后一次小组会议;5月该会议纪要下发,"523"计划结束。14
 1981年10月,世界卫生组织主办的第四届疟疾化疗研讨会在北京召开上,屠呦呦就《青蒿素的化学研究》一题作首位发言,引起与会代表极大的兴趣,并认为“这一新的发现更重要的意义是在于将为进一步设计合成新药指出方向”。在这次报告中,屠呦呦提出应研发复方青蒿素以防止和延缓抗药性出现的设想,但并未受到国际同行的重视,中国开始自行研发复方药物,开发出复方蒿甲醚等系列复方药。2005年,医学刊物《柳叶刀》发表文章,指出研究发现使用单方青蒿素的地区疟原虫对青蒿素敏感度下降,这意味着疟原虫有开始出现抗药性的可能,世卫组织开始全面禁止使用单方青蒿素,改用青蒿素的联合疗法(artemisinin combination therapy,ACT),并推荐多种联合治疗, 即每种方案包括青蒿素类化合物, 配以另1 种化学药物。这说明当年中国科学家的预见是对的。15
1981年10月,世界卫生组织主办的第四届疟疾化疗研讨会在北京召开上,屠呦呦就《青蒿素的化学研究》一题作首位发言,引起与会代表极大的兴趣,并认为“这一新的发现更重要的意义是在于将为进一步设计合成新药指出方向”。在这次报告中,屠呦呦提出应研发复方青蒿素以防止和延缓抗药性出现的设想,但并未受到国际同行的重视,中国开始自行研发复方药物,开发出复方蒿甲醚等系列复方药。2005年,医学刊物《柳叶刀》发表文章,指出研究发现使用单方青蒿素的地区疟原虫对青蒿素敏感度下降,这意味着疟原虫有开始出现抗药性的可能,世卫组织开始全面禁止使用单方青蒿素,改用青蒿素的联合疗法(artemisinin combination therapy,ACT),并推荐多种联合治疗, 即每种方案包括青蒿素类化合物, 配以另1 种化学药物。这说明当年中国科学家的预见是对的。15
1986年,青蒿素和双氢青蒿素获一类新药证书,1992年获得“全国十大科技成就奖”,1997年获得“新中国十大卫生成就”之一称号。161
2011年9月,屠呦呦因青蒿素和双氢青蒿素的贡献,获得被誉为诺贝尔奖风向标的拉斯克奖。17
2015年10月,屠呦呦因创制新型抗疟药—青蒿素和双氢青蒿素的贡献,“or her discoveries concerning a novel therapy against Malaria”,与另外两位科学家获2015年度诺贝尔生理学或医学奖。1819
2016年,科学杂志《eLife》刊登,德国马克斯普朗克分子植物生理学研究所专家发明了利用COSTREL方法从烟草中大量提取青蒿素的方法。2021
理化性质青蒿素(Artemisinin)是从复合花序植物黄花蒿茎叶中提取的有过氧基团的倍半萜内酯药物,是一种无色针状晶体,化学名称为(3R,5aS,6R,8aS,9R,12S,12aR)-八氢-3,6,9-三甲基-3,12-桥氧-12H-吡喃〔4,3-j〕-1,2-苯并二塞平-10(3H)-酮。分子式为C15H22O5,属倍半萜内酯,具有过氧键和6-内酯环,有一个包括过氧化物在内的1,2,4-三噁结构单元,这在自然界中十分罕见,分子中包括有7个手性中心,它的生源关系属于amorphane类型,其特征是A,B环顺联,异丙基与桥头氢呈反式关系。
制备熔点为156-157℃, [a]D17=+66.3°(C=1.64氯仿)。易溶于氯仿、丙酮、乙酸乙酯和苯,可溶于乙醇、乙醚,微溶于冷石油醚,几乎不溶于水。因其具有特殊的过氧基团,它对热不稳定,易受湿、热和还原性物质的影响而分解。22
制备化学合成化学合成青蒿素难度极大,1986年,中国科学院上海有机所以R(+)一香草醛为原料合成了青蒿素,国外也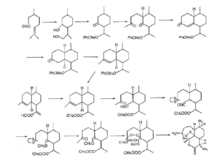 有类似工作,反应以(-)- 2-异薄勒醇为原料,通过光氧化反应引进过氧基,保留原料中的六元环,环上三条侧链烷基化,形成中间体,最后环合成含过氧桥的倍半萜内酯。但过程均过于复杂,尚未显示出商业的可行性。232425
有类似工作,反应以(-)- 2-异薄勒醇为原料,通过光氧化反应引进过氧基,保留原料中的六元环,环上三条侧链烷基化,形成中间体,最后环合成含过氧桥的倍半萜内酯。但过程均过于复杂,尚未显示出商业的可行性。232425
生物合成萜类化合物的生物合成途径非常复杂,对于青蒿素这一类低含量的复杂分子的生物合成研究更是如此。用以下三种途径可生物合成青蒿素:(1)通过添加生物合成的前体来增加青蒿素的含量;(2)通过对控制青蒿素合成的关键酶进行调控,或者对关键酶控制的基因进行激活来大幅度增加青蒿素的含量;(3)利用基因工程手段来改变关键基因以增强它们所控制酶的效率。26
对于倍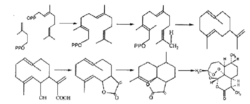 半萜内酯的合成,其限速步骤一是环化和折叠成倍半萜母核的过程,另一个限速步骤为形成含过氧桥的倍半萜内酯过程。研究人员通过放射性元素示踪法对青蒿素的生物合成途径进行了研究,认为青蒿素的生物合成可以从法尼基焦磷酸出发,经耗牛儿间架(germacrane)、双氢木香交酯(dihydrocostunodile)、杜松烯内酯(cardinanolide)和青蔷素B(arteannuin B),最终合成青蒿素。2728
半萜内酯的合成,其限速步骤一是环化和折叠成倍半萜母核的过程,另一个限速步骤为形成含过氧桥的倍半萜内酯过程。研究人员通过放射性元素示踪法对青蒿素的生物合成途径进行了研究,认为青蒿素的生物合成可以从法尼基焦磷酸出发,经耗牛儿间架(germacrane)、双氢木香交酯(dihydrocostunodile)、杜松烯内酯(cardinanolide)和青蔷素B(arteannuin B),最终合成青蒿素。2728
除青蒿,其他植物并非不可行。2011 年研究人员使用甲羟戊酸,从烟草中合成出了青蒿素。29
提取商用的青蒿素主要来自于植物提取物,理论上植物中青蒿素含量达以上的青篙才有提取青蒿素的价值。而天然植物中青蒿素的含量受地理环境、采集时间、采集部位、气温和施肥等因素的影响。中国北方产的黄花蒿中青蒿素含量极低。20世纪60-70年代就有单位进行过中药青蒿的分离研究,但未有所获,后来推测可能和产地分布有关。即使在能够提取青蒿素的地区,不同产地青蒿素的含量差异也很显著,最高可达干重的1-2%。有人认为青篙的采集期在生长盛期至花蕾期之前较好,一天中采集时间以晴天中午12-16时为宜。而在青篙植物的上部和枝条上部的叶片中,青篙素含量最高,嫩叶比老叶的含量高。不同干燥方法也有一定的影响,自然晒干的效果比阴干的样品含量高。
从青蒿中提取青蒿素的方法是以萃取原理为基础,主要有乙醚浸提法和溶剂汽油浸提法。挥发油主要采用水蒸汽蒸馏提取,减压蒸馏分离,其工艺为:投料---加水---蒸馏---冷却---油水分离---精油;非挥发性成分主要采用有机溶剂提取,柱层析及重结晶分离,基本工艺为:干燥---破碎---浸泡、萃取(反复进行)---浓缩提取液---粗品---精制。30
相对具体方法比如,丙酮一硅胶柱层析法,将植物青篙的叶子和花蕾用丙酮浸泡二次,每次一小时,合并滤出液,常压回收丙酮至小体积,然后加入乙醇于小体积的丙酮提取液中进行脱蜡,在50℃以下搅拌混匀,使其基本溶解后,在10℃以下放置12小时,用纱布过滤。所得乙醇滤液进行层析分离,可得青蒿素。或用低沸汽油-超短粗型球状扩孔硅胶过滤层吸法,采用低沸点汽油为溶剂,反复热回流浸提青蒿干碎叶,热回流时间至少10小时,反复至少4次,将提取液通过装有球形扩孔硅胶的超短粗柱,进行选择性过滤。采用异丙醇或醋酸乙酷同低沸点汽油的混合液为洗脱液通过柱体进行洗脱,然后浓缩流出液,即得青蒿素粗品。3132
也可采取超临界法提取,比如在提取压力8-32MPa,提取温度30-70℃,解析压力4-8MPa,解析温度30-70℃下通过循环分离青蒿素,提取时间0.5-5小时,提取率可达92%。32
青蒿素的提取方法虽多,但弊端同样不少。汽油法简练,工艺流程短,操作方便,但此法大量消耗汽油,安全性存在问题,且由于沸点高,母液处理困难,需减压回收,回收率低。乙醇法溶剂回收温度较难控制,有效成份易受破坏,收率低。硅胶层析法用硅胶做吸附剂,一次性使用,用量大,成本高,装柱困难,而且分离时间长,分离效果差,溶剂用量大。超临界法速度快,效率高,但投资高。
利用植物组织培养来生产青篙素是青篙素研究的另一热点,可能成为大规模生产青篙素的重要手段。自80年代以来,植物组织培养生产青篙素的研究工作已进行不少,已经在青篙愈伤组织、悬浮细胞、芽和毛状根等培养体系中进行了青篙素合成的探索。
检测光谱特征吸收峰为红外光谱在1740cm-1的六元环内酯和881、995、1115cm-1的过氧基键。不含碳碳双键。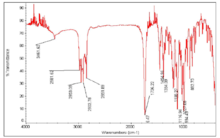
紫外吸收很弱,只在其末端(203 nm)有弱吸收。没有荧光发射团,也没有衍生化基团。因此它的定量分析有一定的难度。
33
药理学与以往的抗疟药物不同,青蒿素抗疟机理的主要作用在通过对疟原虫表膜线粒体功能的干扰,导致虫体结构的全部瓦解,而不是借助于干扰疟原虫的叶酸代谢。具体药理作用分两步:活化,青蒿素被疟原虫体内的铁催化,其结构中的过氧桥裂解,产生自由基;烷基化,第一步所产生的自由基与疟原虫蛋白发生络合,形成共价键,使疟原虫蛋白失去功能死亡。34
主要用途以青蒿素类药物为主的联合疗法已经成为世界卫生组织推荐的抗疟疾标准疗法。世卫组织认为,青蒿素联合疗法是当下治疗疟疾最有效的手段,也是抵抗疟疾耐药性效果最好的药物,而中国作为抗疟药物青蒿素的发现方及最大生产方,在全球抗击疟疾进程中发挥了重要作用。尤其在疟疾重灾区非洲,青蒿素已经拯救了上百万生命。根据世卫组织的统计数据,自2000年起,撒哈拉以南非洲地区约2.4亿人口受益于青蒿素联合疗法,约150万人因该疗法避免了疟疾导致的死亡。在西非的贝宁,当地民众都把中国医疗队给他们使用的这种疗效明显、价格便宜的中国药称为“来自遥远东方的神药”。35
此外青篙素在其他疾病的治疗中也显示出诱人的前景。如抗血吸虫、调节或抑制体液的免疫功能、提高淋巴细胞的转化率,利胆,祛痰,镇咳,平喘等。已研制出了第二代换代产品和用青篙素治疗肿瘤、黑热病、红斑狼疮等疾病的衍生新药,同时开始探索青篙素治疗艾滋病、恶性肿瘤、利氏曼、血吸虫、涤虫、弓形虫等疾病以及戒毒的新用途。
抗疟疾青蒿素是继乙氨嘧啶、氯喹、伯喹之后最热门的抗疟特效药,尤其是对于脑型疟疾和抗氯喹疟疾,青蒿素具有速效和低毒的特点。其抗疟疾作用机理主要在于在治疗疟疾的过程通过青蒿素活化产生自由基,自由基与疟原蛋白结合,作用于疟原虫的膜系结构,使其泡膜、核膜以及质膜均遭到破坏,线粒体肿胀,内外膜脱落,从而对疟原虫的细胞结构及其功能造成破坏,且细胞核内的染色质也受到一定的影响。青蒿素还能使疟原虫对异亮氨酸的摄入量明显减少,从而抑制虫体蛋白质的合成。36
青蒿素的抗疟疾作用与不同的氧气压力有关,氧气压力越高,青蒿素对于体外培养的恶性疟原虫的半数有效浓度会降低。活性氧不仅可以直接对疟原虫起到破坏的作用,而且会损坏红细胞,从而导致疟原虫死亡。黄花蒿除了对疟原虫有很好的杀灭作用外,对其他寄生虫也有一定的抑制作用。20世纪80年代初,经科研人员初步研究发现,青蒿素具有抗血吸虫的作用,研究证实,在整个服用青蒿素药物阶段对幼虫期的血吸虫都能产生杀灭作用。临床证实,青蒿素及其衍生物在治疗疟疾的过程中,并没有发现特别明显的不良反应。37
抗肿瘤青蒿素的抗肿瘤作用逐渐被人们发现。青蒿素能够致使乳腺癌细胞、肝癌细胞、宫颈癌细胞等多种癌细胞的凋亡,对癌细胞的生长具有显著的抑制作用。青蒿素及其衍生物的抗肿瘤作用主要是依靠诱导细胞的凋亡而实现的。研究发现,青蒿素是通过诱导细胞的凋亡而杀灭肿瘤细胞的。双氢青蒿素可以通过增加活性氧,从而抑制激活缺氧诱导的相关因子,发挥出选择性细胞毒作用。青蒿球酯对人的大肠癌细胞也有一定的抑制作用,研究发现,青蒿琥酯对人的大肠癌细胞的增值抑制作用和凋亡促进作用存在剂量依赖性。线粒体是细胞凋亡的放大器和感受器,调节控制着细胞的代谢活动,线粒体的膜电位诱导细胞的凋亡。青蒿素作用于白血病细胞的细胞膜,改变细胞膜的通透性,使得细胞内的钙离子浓度升高,这样不仅使得钙蛋白酶得以激活,使其膨胀死亡,而且促进了凋亡物质的释放,细胞凋亡加快。383940
免疫调节研究发现,青蒿素及其衍生物的使用剂量在不会引起细胞毒性的情况下,能够较好的抑制T淋巴细胞丝裂原,从而诱导小鼠脾脏淋巴细胞的增殖。这一发现对于治疗T淋巴细胞所介导的自身免疫性疾病,有很好的参考价值。青蒿玻醋具有增强非特异性免疫的作用,能够使小鼠血清的总补体活性提高。双氢青蒿素对于B淋巴细胞的增殖,能起到直接的抑制作用,从而减少B淋巴细胞对自身抗体的分泌,减轻体液免疫反应,对体液免疫有一定的抑制作用,减少了免疫复合物的形成。4142
抗真菌青蒿素的抗真菌作用也使得青蒿素表现出了一定的抗菌活性。研究证实青蒿素的渣粉剂和水煎剂对炭疽杆菌、表皮葡萄球菌、卡他球菌、白喉杆菌均有较强的抑菌作用,对结核杆菌、绿脓杆菌、金黄色葡萄球菌、痢疾杆菌等也具有一定的抑菌作用。4344
其他青蒿素在临床上还具有与冬虫夏草合用,可以抑制狼疮肾炎的复发,以达到保护肾脏的功效。其抗纤维化作用,能够显著降低肺组织的纤维化程度,对于瘢痕的预防和治疗有较好的实用前景。4546
另外,青蒿素还可以破坏卡氏肺孢子虫膜系结构,引起孢子虫滋养体胞浆及包囊内出现空泡,线粒体肿胀,核膜破裂,内质网肿胀,囊内小体溶解破坏等超微结构的改变,从而抗卡氏肺孢子虫肺炎。青蒿素类药对胚胎有较高的选择性毒性,较低剂量即可使胚胎死亡而导致流产,有可能被开发为人工流产药物。747
2016年12月1日,在线发表于美国Cell(《细胞》)杂志上的一项研究表明,这一药物或许还可以拯救糖尿病患者。来自奥地利科学院CeMM分子医学研究中心等机构的科学家发现,青蒿素能够让产生胰高血糖素的 细胞“变身”产生胰岛素的细胞。青蒿素结合了一个称为gephyrin的蛋白。Gephyrin能够激活细胞信号的主要开关——GABA受体。随后,无数的生物化学反应发生变化,导致了胰岛素的产生。另一项研究表明,在小鼠模型中,注射GABA也能导致 细胞转化为 细胞,表明两种物质靶向了相同的机制。但青蒿素的长期作用需要进一步测试。48
用法治疗用量①控制疟疾症状(包括间日疟与耐氯喹恶性疟),青蒿素片剂首次 1.0g,6~8h后0.5g,第 2、3日各0.5g。栓剂首次 600mg,4h后 600mg,第 2、3日各 400mg。
②恶性脑型疟,青蒿素水混悬剂,首剂 600mg,肌注,第 2、3日各肌注 150mg。
③系统性红斑狼疮或盘状红斑狼疮,第 1个月每次口服 0.1g,1日 2次,第 2个月每次0.1g,每日3次,第 3个月每次 0.1g,每日 4次。
直肠给药,1次 0.4—0.6g, 1日 0.8—1.2g。
深部肌注,首次200mg,间隔6~8小时后再肌注100mg,第二、三日各肌注100mg,总量500mg;肌注300mg/日,连用3日,总量900mg。小儿15mg/kg,按上述方法3日内注完。
口服,首次服1g,间隔6~8小时后再服0.5g,第二、三日各服0.5g。3日为1疗程。
副作用1 有轻度恶心、呕吐及腹泻等,不加治疗能很快恢复正常。
2 注射部位浅时,易引起局部疼痛和硬块。
3 个别病人,可出现一过性转氨酶升高及轻度皮疹。
4 妊娠早期妇女慎用。
本词条内容贡献者为:
蒲富永 - 教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国