简介
理想气体混合物的分压定律与分体积定律:
人们在生产和生活实践中遇到的大多数气体都是气体混合物。早在19世纪,科学家在对低压混合气体的实验研究中,就总结出两条重要的定律,即道尔顿(Dalton)提出的分压定律和阿马格(Amagat)提出的分体积定律。
阿马格分体积定律:
在一个气体混合物中,任意组分气体B的分体积定义为
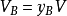
式中,yB是混合气体中气体B的摩尔分数,V是混合气体的总体积。对于一个由N种气体构成的气体混合物,必有
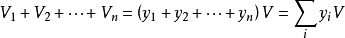
定律解释定律表明,在气体混合物中,所有组分气体的分体积之和等于混合气体的总体积。所以可把分体积VB看作组分气体B对总体积的贡献。
设温度为T、压力为p的容器中,装有理想气体混合物,混合气体的总体积为V,物质的量为n,则
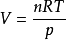
将此式代入,得
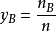
所以
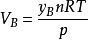
上式右端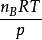 的物理意义是,物质的量为nB的理想气体B在温度为T、压力为p时所具有的体积。
的物理意义是,物质的量为nB的理想气体B在温度为T、压力为p时所具有的体积。
于是上式告诉我们:在理想气体混合物中,某组分气体的体积等于在相同温度T和相同压力p时该气体单独存在时所占有的体积。结合式
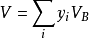
亦可得出如下结论:混合气体的总体积等于混合气体中各组分气体在与混合气体具有相同温度和相同压力条件下单独存在时所占有的体积之和。这就是阿马格分体积定律。分体积定律同样只适用于理想气体混合物,对于真实气体,其各组分的体积不等于它单独存在时所占有的体积,当然分体积定律不能成立。在低压下的真实气体混合物近似服从阿马格分体积定律。2
气体物质的量分数与分体积的关系气体混合物中组分B的分体积与总体积之比可用理想气体状态方程得出
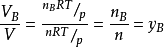
即
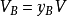
式中 yB——组分B的物质的量分数
此式表明,混合气体中任一组分的分体积等于该组分的物质的量分数与总体积的乘积。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国