合成气是以一氧化碳和氢气为主要组分,用作化工原料的一种原料气。合成气的原料范围很广,可由煤或焦炭等固体燃料气化产生,也可由天然气和石脑油等轻质烃类制取,还可由重油经部分氧化法生产。
简介以氢气、一氧化碳为主要组分供化学合成用的一种原料气。由含碳矿物质如煤、石油、天然气以及焦炉煤气、炼厂气、污泥和生物质等转化而得。生物质和污泥在热解或者气化时也会产生大量的合成气,从形成的气体成分区分的,按合成气的不同来源、组成和用途,它们也可称为煤气、合成氨原料气、甲醇合成气(见甲醇)等。合成气的原料范围极广,生产方法甚多,用途不一,组成(体积%)有很大差别:H2 32~67、CO 10~57、CO2 2~28、CH4 0.1~14、N2 0.6~23。
制造合成气的原料含有不同的H/C摩尔比:对煤来说约为11;石脑油约为2.4:1;天然气最高为4:1。由这些原料所制得的合成气,其组成比例也各不相同,通常不能直接满足合成产品的需要。例如:作为合成氨的原料气,要求H/N2=3,需将空气中的氮引入合成气中(见合成氨原料气);生产甲醇的合成气要求 H2/CO≈2或(H2-CO2)/(CO+CO2)≈2;用羰基合成法生产醇类时,则要求H2/CO≈1;生产甲酸、草酸、醋酸和光气等则仅需要一氧化碳。为此,在合成气制得后,尚需调整其组成,调整的主要方法是利用水煤气反应(变换反应), 以降低一氧化碳,提高氢气的含量。
历史沿革合成气的生产和应用在化学工业中具有极为重要的地位。早在1913年已开始从合成气生产氨,现在氨已成为最大吨位的化工产品。从合成气生产的甲醇,也是一个重要的大吨位有机化工产品。1939年,德国开发的乙炔氢羧化工艺曾是生产丙烯酸及其酯的重要方法。第二次世界大战期间,德国和日本曾建立了十多座以煤为原料用费托合成从合成气生产液体燃料(见煤间接液化)的工厂,战后由于有廉价的原油,这些厂先后关闭。1945年,德国鲁尔化学公司用羰基合成(即氢甲酰化)法生产高级脂肪醛和醇开发成功,此项工艺技术发展很快。60年代,在传统费托合成的基础上,南非开发了SASOL工艺,生产液体燃料并联产乙烯等化工产品,以适应当地的特殊情况。1960年,联邦德国巴登苯胺纯碱公司的甲醇羰基化生产醋酸工艺工业化;1970年,美国孟山都公司对此法作了重大改进,使之成为生产醋酸的主要方法,进而带动了有关领域的许多研究。70年代石油涨价以后,又提出了碳一化学的概念。对合成气应用的研究,引起了各国极大的重视。
化学产品由合成气可以生产一系列的化学品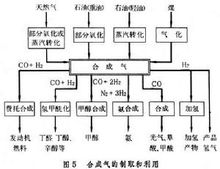
氨及其产品最主要的合成气化学品,是用合成气中的氢和空气中的氮在催化剂作用下加压反应制得的氨。氨加工产品有尿素、各种铵盐(如氮肥和复合肥料)、硝酸、乌洛托品、三聚氰胺等。它们都是重要的化工原料。
甲醇及其产品甲醇是合成气化学品中第二大产品,是一氧化碳和氢气在催化剂作用下反应制得的,其用途和加工产品 十分广泛。甲醇羰基化制得醋酸,是生产醋酸的主要方法(见彩图);甲醇经氧化脱氢可得甲醛,进一步可制得乌洛托品,后两者都是高分子化工的重要原料。由醋酸甲酯羰基化生产醋酐,被认为是当前生产醋酐最经济的方法,1983年,美国田纳西伊斯曼公司建立了一个年产226.8kt(5亿磅)的工厂。此外,正在开发的尚有通过二醋酸乙二醇酯制醋酸乙烯,由甲醇生产低碳烯烃,由甲醇同系化生产乙醇,由甲醇通过草酸酯合成乙二醇等工艺。
十分广泛。甲醇羰基化制得醋酸,是生产醋酸的主要方法(见彩图);甲醇经氧化脱氢可得甲醛,进一步可制得乌洛托品,后两者都是高分子化工的重要原料。由醋酸甲酯羰基化生产醋酐,被认为是当前生产醋酐最经济的方法,1983年,美国田纳西伊斯曼公司建立了一个年产226.8kt(5亿磅)的工厂。此外,正在开发的尚有通过二醋酸乙二醇酯制醋酸乙烯,由甲醇生产低碳烯烃,由甲醇同系化生产乙醇,由甲醇通过草酸酯合成乙二醇等工艺。
费托合成产品合成气在铁催化剂作用下加压反应生成烃,也可发展为生产汽油和丙酮、醇等低沸点产品。这类生产在特殊情况下尚有意义(见费托合成)。
氢甲酰化产品即羰基合成的产品,包括直链和支链的C2~C17烯烃与合成气进行氢甲酰化反应的产品。羰基合成生成 醛,再进一步催化加氢制得醇。它们是制增塑剂的重要原料。
醛,再进一步催化加氢制得醇。它们是制增塑剂的重要原料。
此外,正在开发中的尚有用合成气直接合成乙二醇、乙醇、醋酸、1,4-丁二醇等重要化工产品。(见彩图)
生产方法第二次世界大战前,合成气主要是以煤为原料生产的;战后,主要采用含氢更高的液态烃(石油加工馏分)或气态烃(天然气)作原料。1970年代以来,煤气化法又受到重视,新技术及各种新的大型装置相继出现,显示出煤在合成气原料中的比重今后将有可能增长,但主要从烃类生产合成气,所用方法主要有蒸汽转化和部分氧化两种。
蒸汽转化此法以天然气或轻质油为原料,与水蒸气反应制取合成气。1915年,A.米塔斯和C.施奈德用蒸汽和以甲烷为主的天然气,在镍催化剂上反应获得了氢。1928年,美国标准油公司首先设计了一台小型蒸汽转化炉生产出氢气。第二次世界大战期间,开始用此法生产合成氨原料气。
天然气蒸汽转化主要反应为:
主要工艺参数是温度、压力和水蒸气配比。由于此反应是较强的吸热反应,故提高温度可使平衡常数增大,反应趋于完全。压力升高会降低平衡转化率。但由于天然气本身带压,合成气在后处理及合成反应中也需要一定压力,在转化以前将天然气加压又比转化后加压经济上有利,因此普遍采用加压操作,同时增加水蒸气用量以提高甲烷转化率。高水蒸气用量也可防止催化剂上积炭。除上述主要反应外,还有下列反应发生:
此两反应均为放热反应。
在温度 800~820℃、压力2.5~3.5MPa、H2O/C摩尔比3.5时,转化气组成(体积%)为:CH410、CO10、CO210、H269、N21。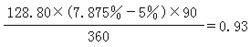
为在工业上实现天然气蒸汽转化反应,可采用连续转化和间歇转化两种方法。
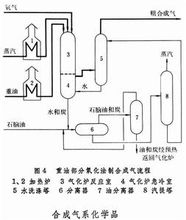
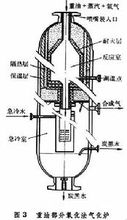
①连续蒸汽转化流程 这是现有合成气的主要生产方法(图1)。在天然气中配以0.25%~0.5%的氢气,加热到380~400℃时,进入装填有钴钼加氢催化剂和氧化锌脱硫剂的脱硫罐,脱去硫化氢及有机硫,使总硫含量降至0.5ppm以下。原料气配入水蒸气后于 400℃下进入转化炉对流段,进一步预热到 500~520℃,然后自上而下进入各支装有镍催化剂的转化管,在管内继续被加热,进行转化反应,生成合成气。转化管置于转化炉中,由炉顶或侧壁所装的烧嘴燃烧天然气供热(见天然气蒸汽转化炉)。转化管要承受高温和高压,因此需采用离心浇铸的含25%铬和20%镍的高合金不锈钢管。连续转化法虽需采用这种昂贵的转化管,但总能耗较低,是技术经济上较优越的生产合成气的方法。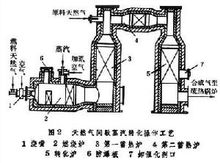
合成气
②间歇蒸汽转化流程 亦称蓄热式蒸汽转化法。采用周期性间断加热来补充天然气转化过程所需的反应热(图2)。过程可分为两个阶段:首先是吹风(升温、蓄热)阶段:一部分天然气首先作为燃料与过量空气在燃烧炉内进行完全氧化反应,产生1300℃左右的高温烟气,经第一、二蓄热炉进入转化炉,从上而下穿过催化剂层,使催化剂吸收一部分热量。同时,烟气中的残余氧与催化剂中的金属镍发生氧化反应放出大量的热,进一步提高床层温度。烟气从转化炉底部出来时约850℃左右,经回收热量后放空。然后是制气阶段:作为原料的天然气与水蒸气(如生产合成氨则另加空气)经蓄热炉预热到950℃左右,进入催化剂床层进行蒸汽转化反应。从催化剂床层出来的气体,温度约 850℃左右,同样经回收热量后,存入合成气气柜。中国曾采用间歇蒸汽转化炉,建设了一批小型合成氨厂,这些厂不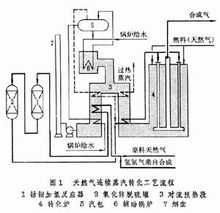 用昂贵的合金钢转化管,其主要设备为耐火材料衬里的圆筒型转化炉,结构简单,建设费用低廉。缺点是常压操作,设备庞大,占地多,操作费用较高。国际上还有用此法生产城市煤气的。1
用昂贵的合金钢转化管,其主要设备为耐火材料衬里的圆筒型转化炉,结构简单,建设费用低廉。缺点是常压操作,设备庞大,占地多,操作费用较高。国际上还有用此法生产城市煤气的。1
轻质油蒸汽转化是50年代英国卜内门化学工业公司开发的,1959年建成第一座工厂。此法主要反应为: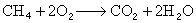
在许多方面与天然气蒸汽转化相似。C/H比较高,更因其中除烷烃外,还有芳烃甚至少量烯烃,易生成炭而析出,因此必须采用抗析炭的催化剂。一般仍采用镍催化剂,而以氧化钾为助催化剂,氧化镁为载体。轻质油中含硫一般较天然气为高,而此催化剂对硫又很敏感,因此在蒸汽转化前,需先严格脱硫,并同时加氢。裂化轻油脱硫十分困难,极少用来制取合成气。用来制合成气的是直馏轻质油。由于轻质油价格较高,又有上述不利之处,因此只有在缺少天然气供应的地区,才发展以轻油原料的合成气生产。
部分氧化 天然气或轻质油蒸汽转化的主要反应为强吸热反应,反应所需热量由反应管外燃烧天然气或其他燃料供给,而部分氧化法则是把管内外反应合为一体。本法可不预脱硫,反应器结构材料比蒸汽转化法便宜。此外,更主要的优点是不择原料,几乎从天然气到渣油的任何液态或气态烃都能适用。
天然气部分氧化加入不足量的氧气,使部分甲烷燃烧为二氧化碳和水:
此反应为强放热反应。在高温及水蒸气存在下,二氧化碳及水蒸气可与其他未燃烧甲烷发生吸热反应:
所以主要产物为一氧化碳和氢气,而燃烧最终产物二氧化碳不多。反应过程中为防止炭析出,需补加一定量的水蒸气。这样做同时也加强了水蒸气与甲烷的反应。
天然气部分氧化可以在催化剂的存在下进行,也可以不用催化剂。
①非催化部分氧化 天然气、氧、水蒸气在3.0MPa或更高的压力下,进入衬有耐火材料的转化炉内进行部分燃烧,温度高达1300~1400℃,出炉气体组成(体积%)约为:CO25、CO42、H252、CH40.5。反应器用自热绝热式。
②催化部分氧化 使用脱硫后的天然气与一定量的氧或富氧空气以及水蒸气在镍催化剂下进行反应。当催化床层温度约900~1000℃、操作压力3.0MPa时,出转化炉气体组成(体积%)约为: CO27.5、CO25.5 、H267、CH4




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国