碱强度超过强碱(即pKa>26)的碱为超强碱。有布仑斯惕超强碱,路易斯超强碱。有固体、液体两类超强碱。用于催化某些化学反应的超强碱为超强碱催化剂。
简介含义超强碱就是碱性较强的物质。超强碱尚没有明确的定义,但大部分化学家以氢氧化钠作为强碱和超强碱的界限。超强碱的例子有格林尼亚试剂、氮化锂、氢化钠、氢化钙等。
超强碱能够将含氢化合物脱质子化,即Nu + HR=R + HNu(省略电荷)例如:氧负离子能够脱去丙烷中β碳上的质子,使之形成碳负离子:O2- + CH3CH2CH3 = OH- + [CH3CHCH3]-。超强碱一样能和路易斯酸反应,生成酸碱加合物,例如CH3- + CO2 = CH3COO-。超强碱是含有较强活性电子对的分子或负离子。他们具有碱的通性:能够在水中完全水解产生氢氧根:Nu + H2O = HNu + OH-(忽略Nu及HNu的电荷) 因此在水溶液中不能区分这些碱的强弱,这被称为间的拉平效应。但是如果换一种溶剂使碱的解离程度产生差异,即可区分碱的强弱。
大多数超强碱是具很强脱质子能力的负离子,这些负离子必须存在于某种溶液体系或者是离子化合物中,因此需要特有的惰性阳离子(即碱根阳离子)与其配对,而大多数金属阳离子会与强碱发生路易斯酸碱反应,形成稳定的酸碱对而降低超强碱的活性,对于碱性较弱的阴离子超强碱,一般采用惰性阳离子与之形成盐型化合物,如:LiNH2晶体、NaCHF2晶体。而碱性更大的超碱甚至会和传统意义上的惰性阳离子发生配位,造成其在极性溶剂中的溶解度下降或者碱的活性下降,此时可以构造一些配位阳离子作为其碱根阳离子。
举例施洛瑟碱(Schlosser碱):施洛瑟碱是一种超强碱,由烷基锂及醇钾混合而成。最常见的施洛瑟碱是正丁基锂与叔丁醇钾的混合物。
因为锂和醇基中氧的亲和力,正丁基锂和叔丁醇钾交换阳离子成为正丁基钾及叔丁醇锂,而正丁基锂的锂被钾置换后,使得正丁基的离子性变强,因此整体的碱性也随之增加。施洛瑟碱的命名是纪念其发现者曼弗雷德·施洛瑟。
类施洛瑟碱:类施洛瑟碱的原理和施洛瑟碱类似,是利用交换阳离子的原理生成一个碱性较弱的路易斯加合物,并释放惰性更大的阳离子和活性更强的碱性阴离子。例如:芳香基银的甲苯溶液中加入二异丙基亚氨基铯,因为银和亚胺基氮的亲和力,芳香基银和二异丙基亚氨基铯交换阳离子形成芳香基铯和二异丙基亚氨基银(如果二异丙基亚氨基铯过量则还会生成Cs[AgN2(R2)2])络合物),同样使芳香基离子性变强,体系碱性增强。AgB2H5的Si4H10溶液中加入二异丙基亚氨基铯将会爆炸。1
分类液体超强碱过去一般认为,三甲基硅烷基氯化镁[Me3SiMgCl]是已知的能以溶液形式存在的最强的碱。其对应的共轭酸为三甲基硅烷[Me3SiH],其pKa=70。用一倍物质的量的硅化镁固体和三倍物质的量的一氯甲烷反应可以制得三甲基硅烷基氯化镁。反应如下:
3CH3Cl + Mg2Si = (CH3)3SiMgCl + MgCl2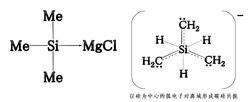
用三甲基硅烷液体作为溶剂,溶解提取出生成的三甲基硅烷基氯化镁,即得到20%-40%的碱液。
从组成上来看,可以认为这是一种格氏试剂。
氟化银和B2H4反应得Ag[BH2F]2,再与LiH缓慢作用,制得AgB2H5。其结构如右图所示: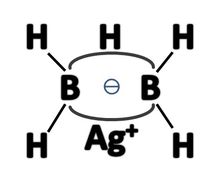
相当于银原子取代了乙硼烷中位于氢桥键上的氢原子的位置。一价银离子离去后,剩下一个二中心二电子的“孤电子对桥”,它极易结合一个质子形成其共轭酸——乙硼烷。乙硼烷的pKa=110,事实上B2H6中的氢已经带有负电荷,B2H5-和质子这个反应相当于氧化还原反应。
AgB2H5只存在用丁硅烷(Si4H10)作为溶剂的溶液中。B-Ag-B为离子性很强的共价结构。低温下稳定,常温下易爆炸分解为单质银、氢气及高级硼氢化合物。
理论上来说,氢化锂和B2H4反应会直接制得LiB2H5,为离子化合物。这种化合物碱性较强,活性极大。其丁硅烷溶液是最强的碱性溶液之一。
固体超强碱三甲基硅烷基氯化镁、AgB2H5、LiB2H5是能够以溶液的形式存在的最强碱,但如果说三甲基硅烷基氯化镁、AgB2H5、LiB2H5是普遍意义上的最强碱,那还差之甚远。固体超强碱,如Li4C、Mg2Si、Na3B(硼化三钠)等,其对应的共轭酸pKa值往往超过120,甚至达到150-160。他们的碱性强到几乎不能够以溶液形态存在。例如:Na3B溶解于丁硅烷Si4H10会发生配位反应,生成[(Si4H10)B4]12-而后析出氢化钠形成硼硅加合物。另外有些碱如Li3N、Ag3N等,难溶于大多数有机溶剂,却能在固相中发生很强的碱性反应。他们也被称为固体超强碱。2

本词条内容贡献者为:
陈铁桥 - 副教授 - 湖南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国