穴状化合物,简称穴合物。聚多环配体有针对性地和某些金属离子形成的配位化合物。
含有氮或硫原子的大环化合物具有与冠醚相似的性质,含有多于一种杂原子的大环化合物也如此。像这样的双环分子能从三维立体角度将相应的离子包裹,它与离子的结合比单环冠醚更紧。双环或更多环的化合物称为穴状配体(cryptand),形成的复合物称为穴状化合物(cryptate) 。单环化合物有时也被称作穴状配体。1
举例及命名如18-冠醚-6,“18”表示环原子总数,“6”表示能和金属离子结合形成配位化合物的氧原子数。在碱金属离子中,铷太大,锂太小,它只能选择性地和钾离子结合,因而能从混合物中单一地萃取钾。由于形成的配位化合物外观似皇冠,故名“冠醚”。环聚醚的氧原子可为氮或硫原子等取代。这些穴合剂和金属离子结合时,选择性极高,形成的穴合物稳定性差别极大,有潜在的应用价值。如作为选择性极高的催化剂或从海水中单一地提取铀或金等贵金属。
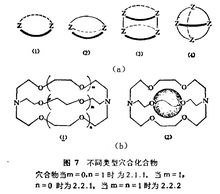
由来及特点穴状化合物(CryPtate)是巨多环的络合物,这方面的研究在70年代有了迅速的发展。巨多环作为配体有特别高的选择性,与金属形成的络合物特别稳定.最简单的是单环(图7(a1)),较复杂的为双环(图7(a1))、三环(图7(a3))和四环(图7(a4))。它们的形状可以是柱状,也可以是球状等。最初研究的是聚醚(图7(b))。双环聚醚与碱金属离子形成穴合物都比较稳定。但对各个碱金属离子化合物的稳定性则因环的大小不同而有很大的差别。如双环聚醚2.1.1的钠络合物最稳定,而双环聚醚2.2.2的钾络合物最稳定。因此,它们可用作制备碱金属离子选择性电极的原材料。聚醚与碱土金属离子也形成较稳定的穴合物。
聚醚的氧原子可为N或S原子所取代。取代后与碱金属和碱土金属离子所形成的穴合物即不稳定。但与其他类离子如Ag+、Ti+、Cd2+、Pb2+的化合物的稳定性则增高。例如,把聚醚2.2.2的一个**“=O”改为“=NCH3”**,Pb(Ⅱ)络合物的稳定性就提高103倍,Cd(Ⅱ)络合物的稳定性提高105倍。从上述可见,穴合物的选择性和所形成的穴合物的稳定性是受穴合物环的多寡、大小、配位原子(O、S、N或P)和连于配位原子的取代基团等因素的显著影响的。因此,有人认为调节这些因素应可能使穴合剂的选择性达到如此高的地步,以致能够从海水中提取铀或金等贵重元素。总之,穴合物无论从基础理论的研究或实际应用,都是一类前途未可限量的化合物。2
配合物三环穴状配体具有10个结合位点和球形的空腔。另一个具有球形空腔的分子(但是它不是一个穴状配体),能与Li+和Na+复合(更易与Na+复合),但不与K+、Mg2+或Ca2+结合。像这些分子,它们的空腔只能被球形的实体占据,被称为球形配体(spherand)。其它的类型还有杯芳烃(calixarene)。在杯[4]芳烃中,苯酚OH存在大量的氢键,但是随着杯芳烃环增大,空腔增大,氢键会消失。此外杯[4]芳烃存在构象异构体的平衡(锥形互变),有时可以将二者分离出来,如杯[8]芳烃和氮杂杯芳烃口。应当指出的是,在未取代的问位加入取代基,可使杯[4]芳烃结构更固定,也可大大减少杯[8]芳烃的构象可变性。人们已经知道有酰胺桥连的杯[4]芳烃、杯[4]薁和醌桥连的杯[4]芳烃,杯[4]芳烃二铵盐也被制得。对映体纯的杯[4]间苯二酚芳烃衍生物已有报道,水溶性的杯[4]芳烃也已被制备出。此外,还有各种各样的杯[n]冠醚,其中有些是穴状配位体。1
本词条内容贡献者为:
王强 - 副教授 - 西南大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国