一种元素的电离电势定义为:从正常原子中剥离结合得最松弛的那个电子所需能量的电子伏特数,电子伏特是一个能量单位,相当于一个电子被1伏特电势差加速所获得的动能。1
电离电势是化学元素的定量特征之一,同时也决定元素在周期系中的位置及由它们组成的化合物的特性和性质。电离电势是核电荷的周期函数。
概念当电子与原子碰撞时,如果加速电子的能量大到足以把原于内的电子撞击出去,使原子变成正离子,这时用以加速电子的电势就称为电离电势。原子基态的电离能(把一个电子从基态的轨道上移到离核无限远处所需要的能量)也称为电离电势。例如,氢的电离能等于13.59765±0.00022电子伏。
勒纳首先在1902年进行测定电离电势的实验。后来夫兰克—赫兹加以改进,并重新测定许多原子的电离电势。2
特点电离是电解质在水溶液或熔融状态下生成自由移动阴阳离子的过程。将电子从基态激发到脱离原子,叫做电离,这时所需的能量叫电离电势能。 例如氢原子中基态的能量为-13.6eV(电子伏特),使电子电离的电离势能就是13.6eV(即2.18×10-18焦耳)。
原子是由带正电的原子核及其周围的带负电的电子所组成,由于原子核的正电荷数与电子的负电荷数相等,所以原子是中性的.原子最外层的电子称为价电子.所谓电离,就是原子受到外界的作用,如被加速的电子或离子与原子碰撞时使原子中的外层电子特别是价电子摆脱原子核的束缚而脱离,原子成为带一个或几个正电荷的离子,这就是正离子.如果在碰撞中原子得到了电子,则就成为负离子。3
电离电势是化学元素的重要特征,因为原子轨道上电子的阻留强度在很大程度上决定这些元素的化学性质;了解它能够较深刻地理解化合物分子中和品格中电子云密度的分布特点。4
在每个周期里,电离电势在增长,遵守某些复杂的定律:最低值I1是碱金属的特征,其原子核在自己的周期范围内具有最小的电荷,所以吸引(单)一的价电子能力小;元素最高的电离电势是第八族元素(隋性气体),它们在自己的周期里原子核电荷最多。4
测定方式如果给予原子足够大的能量,可以使原子中的电子离去,可称为电离。经电场加速的电子与原子相碰时,刚好能够使原子电离,这时的电势差称为电离电势。对电离电势的测量装置如右图所示。5
在一容器中,装有几个电极。图中的K是发射电子的热阴极,G是圆柱形的金属网,外面套一个圆柱形的阳极A圆柱网上、下各有一个平底,其下底的中央开有一小孔,并盖有一层金属网G1。在G1的外侧有一热阴极K1,可以发射电子。G极与K极之间维持一定的电压,而G极与以极为等电位。将容器中的空气抽出,充入被研究的气体,并达到适当的气压。
实验分两步进行:首先在KG间维持一固定的电压。逐渐增加K极的电子发射量,观察KG间电流的变化情况。从电流计的示数可以看出。起初电流是上升的,后来就停止增加了。这是由于KG间电压是固定的,尽管K极发射电子量较大,但不能很快向A极疏散,使得K极周围积存有大量电子,从而限制了K极电子的发射,因此发射量不能再增加。
这时进行实验的第二步,在K1G1间加电压,并逐渐由小变大,于是K1极发射的电子被加速而通过金属网G,进入G1G空间。开始时,对KG间电流不会产生什么影响。但当K1G1间电压达到一定数值时,KG间电流会突然上升。引起这种情况的原因是由于K1G1间电压达到气体的电离电势时,通过G1的电子与气体的原子相碰而使之电离,产生正离子和电子。在G1G网内的空问中,G1极对K极的电位为正,电子引向G1极,而正离子则移向K极,并与K极附近的电子中和,因而减少了对K极电子发射的限制,使得电子发射量增加,于是KG间电流也随之增加。这样,KG电流突然增加,就表示有电离发生,也就是K1G1间的电势差已达到气体电离电势。使用这种方法可测量出许多种原子的电离电势,但是原子的电离电势也可以从光谱的实验中推算出来。
把中性原子中的一个电子电离所需要的电压称为第一电离电势。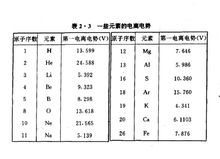
各种元素具有一定的电离电势这一事实表明:从原子的基态到电离状态的能量差是一定的,这也是原子内部能量量子化的一个有力证明。5
本词条内容贡献者为:
张勇 - 副教授 - 西南大学资源环境学院




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国