溶质含量极少的溶液。稀溶液中溶质的摩尔分数趋近于零,而溶剂的摩尔分数趋近于1,所以稀溶液非常接近于理想溶液,稀溶液中溶剂的行 为与它处于理想溶液时的行为相同。
稀溶液中的溶质遵从亨利定律,其溶剂遵 从拉乌尔定律,所以稀溶液也可如下定义:“在定温定压下,溶剂服从拉乌尔定律而溶质服从亨利定律的溶液,就叫作稀溶液”。1
真实稀溶液真实稀溶液是指稀溶液中溶质的摩尔分数趋近于零,而溶剂的摩尔分数趋近于1,这种溶液为真实稀溶液。
真实稀溶液的化学势:μ=μ*+RTlnaB。2
理想稀溶液理想稀溶液,即无限稀溶液,是溶液的理想化模型,指溶质的相对含量趋近于零的溶液。在这种溶液中,溶质分子之间的距离非常远,每一个溶剂分子和溶质分子周围几乎没有溶质分子而完全是溶剂分子。
理想稀溶液的化学势为:μ=μ*+RTlnxB。2
稀溶液的依数性在一定温度和压力下,理想稀溶液的某些热力学性质,决定于溶液中溶质分子的数目,与溶质的物理和化学性质无关。如蒸气压下降、沸点上升、凝固点降低、渗透压等都称为稀溶液的依数性。
蒸气压下降在定温定压下,溶液中溶剂的饱和蒸气压因溶质存在而低于纯溶剂饱和蒸气压现象。
△P=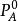 -PA=
-PA=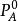 XB
XB
式中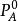 为纯溶剂蒸气压;PA为溶液中溶剂的蒸气压;XB为溶质摩尔分数。即溶剂的蒸气压下降值△P与溶质摩尔分数XB成正比。3
为纯溶剂蒸气压;PA为溶液中溶剂的蒸气压;XB为溶质摩尔分数。即溶剂的蒸气压下降值△P与溶质摩尔分数XB成正比。3
沸点升高溶液的沸点高于纯溶剂的沸点的现象。
△T=Tb-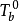 =Kbmb
=Kbmb
式中Tb为溶液沸点;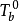 为纯溶剂沸点;mB为溶质的质量摩尔浓度;Kb为沸点上升常数。它表明稀溶液的沸点升高值与溶质(不挥发的)的质量摩尔浓度成正比。3
为纯溶剂沸点;mB为溶质的质量摩尔浓度;Kb为沸点上升常数。它表明稀溶液的沸点升高值与溶质(不挥发的)的质量摩尔浓度成正比。3
凝固点降低溶液的凝固点低于纯溶剂的凝固点的现象。
△Tf=Tf0-Tf=KfmB
式中Tf为溶液的凝固点;Tf0为纯溶剂的凝固点;Kf为凝固点下降常数,实验表明,在稀溶液中,若从溶液中析出的是纯溶剂的固体,溶液的凝固点降低值与溶液浓度mB成正比。3
渗透压在定温定压下,当溶液与纯溶剂(或浓溶液与稀溶液)用半透膜(只允许溶剂分子通过而不允许溶质分子通过的一种膜)隔开时,由于纯溶剂或稀溶液中溶剂的化学势比溶液中(或浓溶液中)溶剂的化学势高,而引起溶剂透过半透膜向溶液(或向浓溶液)扩散的现象称为渗透现象,为制止溶剂分子进入溶液(或浓溶液),需在溶液(或浓溶液)上施加额外压力以增加其蒸气压,使半透膜双方溶剂的化学势相等而达到平衡,该额外加的压力称为渗透压π。
Π=(nB/V)*RT
式中π为渗透压;V为溶液体积;nB为溶质的摩尔数;R为气体普适常数。说明在定温定压下的稀溶液中, 溶质所产生的渗透压与溶液浓度CB成正比。3
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国