速率控制步骤,又称为限速步骤,简称速控步,也译作决速步骤(rate-determining step (RDS))。速率控制步骤指的是如果在一个机理中,其中的一个基元步骤进行的速度远较其他速度慢,则该步骤决定总的反应速率。
基本概念认识一个化学反应当中最慢的一个步骤的重要性在于能够有效率地改善整个化学反应的速度,从而达致更高的产率等。一个常用的比喻就是一条狭窄的水管——无论水流有多快,也无法改变水的流量。
对于实际化学反应来说,并非每个化学反应都为基元反应,多数反应都由几个基本反应共同组成,其中反应速率最慢的反应为速率控制步骤,决定整个化学反应的进程。速率控制步骤就是影响整个化学反应速率的那条水管。
举例与应用以N2O5的分解反应为例解释速率控制方程,该反应不是基元反应,可能按照一下三步机理进行,其中第一步进行两次:
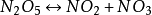
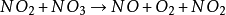 (慢)
(慢)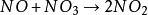
综上,N2O5的分解反应可以写成: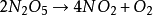 。
。
其中第一步表示一个可逆的分解反应,其前向反应速率常数为K1而逆反应为K1’。在第二步NO2不起反应但影响NO3的分解。如果第二步本身较其它步慢,则速率由下式给出:
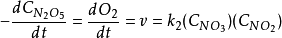 NO的浓度不在速率方程中出现,因为第三步比第二步快,由于第一步也快,而且是可逆的,可以用平衡关系关联这三个组分的浓度:
NO的浓度不在速率方程中出现,因为第三步比第二步快,由于第一步也快,而且是可逆的,可以用平衡关系关联这三个组分的浓度:
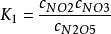 式中
式中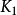 是第一步的平衡常数,利用上式可以消去(CNO2)(CNO3),速率表达式可写为:
是第一步的平衡常数,利用上式可以消去(CNO2)(CNO3),速率表达式可写为:
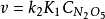
扩散情况下的速率控制步骤宏观动力学方程式中的反应速率常数是化学反应和扩散等因素共同影响的结果。
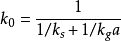
当反应速率加快,而传质速率相对较慢时,即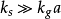 ,这时,上式可简化为:
,这时,上式可简化为: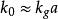 ;
;
当反应速率变慢,而传质速率相对较快时,即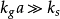 ,这时,上式可简化为:
,这时,上式可简化为: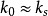 。
。
当一个过程是由若干连续步骤串联而成时,不管这些步骤是化学反应还是扩散,其中速率最慢的步骤将控制整个过程的速率,这一步骤就称为总的过程的反应速率控制步骤。如果若干个步骤反应速率很接近,则整个过程的速率将有几个步骤共同决定。2
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国