在稀溶液中酸碱中和生成1mol水的反应热。1
一元强酸与强碱的中和热约为57kJ,与酸碱种类无关,因为这实际上是1molH+与1molOH-反应生成1molH2O的反应热。
弱酸、弱碱以及多元酸碱的中和热,因有电离热的影响,不是定值。
定义在稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热.
要点1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热.
2.强酸和强碱的稀溶液反应才能保证H+(aq)+OH-(aq)=H2O(l)中和热均为57.3 kJ·mol-1,而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1;
3.以生成1 mol水为基准。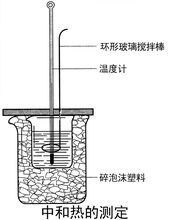
4.反应不可以生成沉淀(如Ba(OH)2+H2SO4=BaSO4+2H2O)
注意点中和热是以生成1 mol H2O所放出的热量来测定的,因此书写它们的热化学方程式时,应以生成1 mol水为标准来配平其余物质的化学计量数。
实例发生中和反应时,由于所用的酸和碱有强弱不同,又有一元、二元或多元之分,因而中和热各不相同。
一元强酸跟一元强碱的中和热
一元强酸跟一元强碱中和时,中和热为57.3 kJ/mol。
一元弱酸跟一元强碱的中和热
如果有一元弱酸或弱碱参加中和反应,其中和热所放出热量一般都低于57.3 kJ/mol,也有个别高于57.3 kJ/mol的。这主要取决于弱酸或弱碱电离时吸热还是放热。
一般地说,弱酸或弱碱的电离是吸热的,因此,中和反应所放出的热量还要扣除电离时吸收的那部分热量,中和热也就低于57.3 kJ/mol。例如,1 mol CH3COOH跟1 mol NaOH溶液反应时,中和热是56.0 kJ/mol。
有的弱电解质电离时是放热的。例如,1 mol氢氟酸电离时放出10.4 kJ/mol热量。当它跟1 mol NaOH溶液反应时,中和热是67.7 kJ/mol。
二元酸跟一元强碱的中和热
 二元酸的电离是分两步进行的,两个H+的中和热各不相同。中和第一个H+的中和热,等于57.3 kJ/mol减去二元酸电离出第一个H+所吸收的热量ΔH1;中和第二个H+的中和热,等于57.3 kJ/mol减去二元酸电离出第二个H+所吸收的热量ΔH2。因此,二元酸跟一元强碱的中和热ΔH可用下式表示:
二元酸的电离是分两步进行的,两个H+的中和热各不相同。中和第一个H+的中和热,等于57.3 kJ/mol减去二元酸电离出第一个H+所吸收的热量ΔH1;中和第二个H+的中和热,等于57.3 kJ/mol减去二元酸电离出第二个H+所吸收的热量ΔH2。因此,二元酸跟一元强碱的中和热ΔH可用下式表示:
ΔH=-〔2×57.3 kJ/mol-(ΔH1+ΔH2)〕
多元酸跟一元强碱的中和热
三元酸跟一元强碱的中和热为ΔH,三元酸里的三个H+电离时所吸收的热量依次是ΔH1、ΔH2、ΔH3,则得:ΔH=-〔3×57.3 kJ/mol-(ΔH1+ΔH2+ΔH3)〕
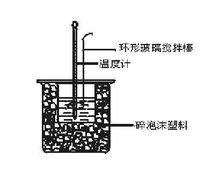
测定步骤在大烧杯底部垫泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过,如下图所示。
2.用一个量筒量取50 mL 0.50 mol/L盐酸,倒入小烧杯中,并用温度计测量盐酸的温度,记入下表。然后把温度计上的酸用水冲洗干净。
用另一个量筒量取50 mL 0.55 mol/L NaOH溶液,并用温度计测量NaOH溶液的温度,记入下表。
把温度计和环形玻璃搅拌棒放入小烧杯的盐酸中,并把量筒中的NaOH溶液一次倒入小烧杯(注意不要洒到外面)。用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度,记为终止温度,记入下表。
重复实验两次,取测量所得数据的平均值作为计算依据。
起始温度关于量HCl和NaOH溶液的起始温度“t1/℃”
①不能以空气的温度去代替酸碱溶液的温度;也不能以水的温度去代替酸碱溶液的温度,因为空气、水和溶液(这里是酸碱)的温度是有差别的,会明显影响实验结果。
②为了使NaOH和HCl溶液的温度稳定,最好是把配成的溶液过夜后使用。
③最好不求HCl和NaOH两种溶液温度的平均值。两者的温度悬殊差别越大,实验结果越是失去意义,最好是两种溶液的温度相同。办法是:用手握住烧杯使温度低的溶液略有升高,或用自来水使温度高的溶液略微降温,以达到两种溶液温度相同的目的。
读者注意,中和热的测定最好在20℃左右的环境温度条件下进行,不宜低于10℃以下,否则低温环境容易散热,会使中和热的测定值明显偏低。
④为什么采用环形玻璃棒搅拌混合液,可不可以用普通玻璃棒?能不能用振荡的方法混匀溶液?
环形玻璃棒的优点在于:上下移动搅拌的面积大、范围广(切不可把环形玻璃棒移出混合液的液面!),混合均匀,普通玻璃棒显然不具有这种优点。
至于振荡混合液,一定会有部分混合液附着在烧杯壁,这样散失的热量会使中和热的测定值偏低。
⑤强酸与弱碱,强碱与弱酸的中和反应热值如何估计?
鉴于弱酸、弱碱在水溶液中只能部分电离,因此,当强酸与弱碱、强碱与弱酸发生中和反应时同时还有弱碱和弱酸的不断电离(吸收热量,即电离热)。
所以,总的热效应比强酸强碱中和时的热效应值(57.3KJ/mol)要小一些。
值得注意的是,有少数弱电解质(如氢氟酸)电离时会放热,它与NaOH的中和热会大于57.3KJ/mol(实为67.7KJ/mol)。
⑥酸碱的浓度该有个什么大小范围?太大、太小对测定值会有什么影响?
如果强酸强碱溶液的浓度太大,混合时由于体积增大,离子继续扩散水合产生热效应。离子的水合热大于扩散热,使总过程放热,使得测得的热值偏高。但是酸碱溶液的浓度也不可太小,否则中和反应放出的热太少,温度变化不大,不易测出。经验指出,测定中和热的酸碱的浓度大小范围以在0.10mol·L~1.0mol·L之间为宜。
⑦本测定有许多难以克服的概略因素:反应容器(烧杯、环形玻璃棒搅拌器)要吸收一些热量,反应混合液的空间要散失一些热量,以及量取溶液体积、温度计读数以及温度计的精确度等都会产生一些误差,所以本测定只能是近似测定强酸强碱的中和热值。
注意事项选择合适浓度的酸溶液和碱溶液进行反应,一般使一种反应物稍过量,通常用0 . 5 0mo l /L的HCl 溶液和0.55mol/L的NaOH溶液,等体积混合,使酸完全反应。选择合适的酸和碱,考虑到浓硫酸遇水放热,而弱酸、弱碱电离时要吸热,以防止其他因素的影响,常以0.50mol/L的HCl溶液和0.55mol/L的NaOH溶液进行实验。2
测定要准确,记录温度要及时,中和热是通过测定温度的变化来计算的,要知道每一阶段溶液的准确温度,需做好温度数据的记录。
注意仪器使用,在测定盐酸溶液的温度后,要用水洗净温度计上的少量酸液,带入到碱溶液中会由于反应放热而影响到碱溶液温度的变化,还应选用两支不同的吸量管分别量取盐酸与氢氧化钠溶液。
注意保温,温度的变化对实验结果会造成较大的误差,测量必须在相对隔热的装置中进行,保证装置的隔热效果,在测量温度时,应该选取混合液的最高温度作为测定值。
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国