交换电流就是当电极处于平衡状态(即不被极化)时,发生再同一电极上的还原反应的绝对电流密度或氧化反应的绝对电流密度。它与电极反应的可逆性有关,它是当电极平衡时单向电极反应速率的一种标志。交换电流很大,则表明在宏观上“静止不变”的电极,但它上面的氧化反应和还原反应却都还在以很高的速率进行。一般说来,在各种电极上氢析出反应的交换电流很不相同。但是交换电流越大,说明电极越容易被极化。
简介设金属电极与含该金属离子的溶液相接触时的电极反应为:
 若以
若以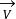 和
和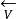 分别表示还原反应(正反应)和氧化反应(逆反应)的速度,而以
分别表示还原反应(正反应)和氧化反应(逆反应)的速度,而以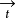 和
和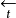 分别表示相应的电流密度,则根据
分别表示相应的电流密度,则根据 (V为单价离子单位时间内在单位面积上反应的摩尔数,F为法拉第常数),n为得失电子数,有:
(V为单价离子单位时间内在单位面积上反应的摩尔数,F为法拉第常数),n为得失电子数,有:

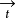 和
和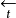 是指同一电极上发生正反两个方向反应的电流密度,是无法测量的。为了与外线路中通过的可以测量的电流区别开,我们把
是指同一电极上发生正反两个方向反应的电流密度,是无法测量的。为了与外线路中通过的可以测量的电流区别开,我们把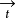 和
和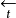 称为内电流(或绝对电流密度)。
称为内电流(或绝对电流密度)。
在外电路中没有电流通过时,电极处于平衡状态。这时宏观上不出现任何物质变化,但在微观上,物质的交换仍然在进行,只是正、反两个方向的反应速度相等。就是说当φ=φ平时,有:
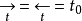
t0称为交换电流密度,简称交换电流。交换电流是在平衡电位下电极上的正向(还原)或反向(氧化)的单向反应速度。它表示电极在平衡条件下的反应能力的大小,可以用它定量地描述电极反应的难易程度。
显然,除了φ平以外,t0是又一个表示电极处于平衡状态的参数。平衡电位相同而交换电流不同的两个电极,其性质是不同的。交换电流大小对电极极化影响很大,交换电流大,表示电极平衡不易破坏,电极不易极化,即电极反应的可逆性大。
交换电流的大小,首先取决于电极反应本性,不同的电极反应,t0相差很大。同一电极在不同成分的溶液中,t0值不同。溶液的浓度和温度、电极材料及其表面状态(光滑或粗糙),也都对t0有影响。
每个电极反应在一定条件下的交换电流密度,可由实验测出。1
交换电流的意义在所有的电化学反应中用实验测定的电流是净电流,它是分别在电极上二个相反方向的电流的差:
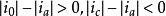
此相反方向的电流变成相同数值时的电位是电化学平衡电位。这里在电极表面上电化学活性物以相同的速度接受和放出电子,其结果不产生净电流(电流不流过外部导线),这就是它的意义。这平衡与所有的化学平衡的情况相同,存在着动力学的问题。多数电子是从一个方向立即向另一个方向的界面运动,所以用如下那样的关系表示:
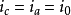
(设有电流流动也未必意味着平衡状态。在很多情况下,这种系统的运动过于慢,可将它看成静止)。交换电流i0不能用实验测定,但可以象前述的那样以塔费尔线的η=0的交点将它求得。交换电流约在10-12~10-2A·cm-2的范围中变动。可逆反应具有高的交换电流是特点,相对的,不可逆反应的特点是具有低的交换电流。这样,交换电流越高反应的可逆性也越高(容易进行)。交换电流对于电极-溶液界面的电子的交换是由这个系统本身原先具备的性质决定的。从外部向此界面施加的电位可以改良此系统的这种性质,使电子向一个方向转移较另一个方向容易,这样产生净的反应,变成在外部回路中有净的电流流过。2
交换电流的测定交换电流是描述电极反应可逆程度的基本动力学参数。它反映了体系所固有的动力学特征。因此在电化学中研究电极过程动力学时,人们总是力图测出电极反应的交换电流。
将金属电极浸入放射性示踪迹溶液中,随着阳极和阴极过程的不断进行,金属表面的比活度逐渐增加,直至稳定离子与放射性离子达到平衡,溶液和金属表面的比活度相等为止。金属表面比活度增加的速度可以用如下的微分方程表示:
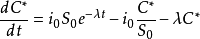 式中,C*——1cm2电极表面的放射性原子数
式中,C*——1cm2电极表面的放射性原子数
Sn——1cm2电极表面的金属原子数;
i0——交换电流;
S0——溶液原始比活度;
λ——放射性衰变常数;
t一交换时间。
在一定条件下(设半衰期T1/2远大于实验时间,e-λt就可以忽略),解此方程得:
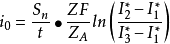 式中,F——法拉弟常数;NA——阿佛加德罗常数;Z——放电离子所带的电荷;l*1、l*2、l*3-t、2t,3t时刻电极表面的放射性计数率。
式中,F——法拉弟常数;NA——阿佛加德罗常数;Z——放电离子所带的电荷;l*1、l*2、l*3-t、2t,3t时刻电极表面的放射性计数率。
用放射性示踪法测定了Ag/Ag+-NH3-吡啶甲酸体系中的交换电流为3.5×10-7安培/厘米2。放射性示踪原子法测定交换电流具有灵敏度高,相对误差小,测试方便等优点。3
交换电流与电化学极化的关系从电极极化产生的原因可以看出,电化学极化是由内电流密度(电极反应本身的速度)t0与外电流密度iC的相对大小所决定的。t0很大时,电化学反应可以在平衡电位附近以一定的速度进行。t0越小,反应进行就越困难,为了维持一定的反应速度tC或tA,需要在电极上积累的剩余电荷就越多,电极电位偏离平衡电位就越远。也就是说,t0越小,则所需要的极化就越大。因此可以根据t0的大小来估计电化学极化的大小。例如,根据下表中的t0值可以推断,当通过相同大小的电流密度iC时,镍电极比铜电极的电化学极化要大得多。这正是在简单镍离子电解液中可以得到细致镍镀层的原因。而要想得到细致的铜镀层,则需要使用配合物电解液以增大阴极极化。
当t0很大时(i0>103A/dm2),一般不会发生电化学极化,这种电极可逆性大,称为难极化电极。反之,若t0很小(i0




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国