氧化还原滴定法是以溶液中氧化剂和还原剂之间的电子转移为基础的一种滴定分析方法。与酸碱滴定法和配位滴定法相比较,氧化还原滴定法应用非常广泛,它不仅可用于无机分析,而且可以广泛用于有机分析,许多具有氧化性或还原性的有机化合物可以用氧化还原滴定法来加以测定。1
相关概念可逆电对(1)能迅速建立起氧化还原平衡;
(2)其电势符合能斯特公式计算的理论电势例: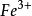 /
/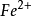 、I2/I-
、I2/I-
不可逆电对 (1)不能建立真正的平衡;
(1)不能建立真正的平衡;
(2)实际电势与理论电势相差较大例: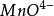 /
/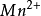 、
、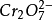 /
/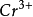
对称电对氧化态与还原态的系数相同。例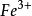 /
/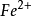
不对称电对氧化态与还原态的系数不同。I2+2e-=2I-,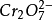 +14
+14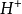 +6e-=2
+6e-=2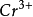 +7
+7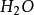
由条件电势考虑到溶液中的实际情况,在能斯特方程中引入相应的活度系数和副反应系数 有: 当C【Ox】=C【Red】=1时,得到条件电势条件电势的意义:表示在一定介质条件下,氧化态和还原态的分析浓度都为1mol/L时的实际电势,在条件一定时为常数。2
试剂选择它以氧化剂或还原剂为滴定剂,直接滴定一些具有还原性或氧化性的物质;或者间接滴定一些本身并没有氧化还原性,但能与某些氧化剂或还原剂起反应的物质。氧化滴定剂有高锰酸钾、重铬酸钾、硫酸铈、碘、碘酸钾、高碘酸钾、溴酸钾、铁氰化钾、氯胺等;还原滴定剂有亚砷酸钠、亚铁盐、氯化亚锡、抗坏血酸、亚铬盐、亚钛盐、亚铁氰化钾、肼类等。3
指示剂氧化还原滴定的等当点可借助仪器(如电位分析法)来确定,但通常借助指示剂来判断。有些滴定剂溶液或被滴定物质本身有足够深的颜色,如果反应后褪色,则其本身就可起指示剂的作用,例如高锰酸钾。而可溶性淀粉与痕量碘能产生深蓝色,当碘被还原成碘离子时,深蓝色消失,因此在碘量法中,通常用淀粉溶液作指示剂。本身发生氧化还原反应的指示剂,例如二苯胺磺酸钠、次甲基蓝等,则在滴定到达等当点附近时,它也发生氧化还原反应,且其氧化态和还原态的颜色有明显差别,从而指示出滴定终点。3
氧化还原指示剂如二苯胺磺酸钠在酸性溶液中以苯胺磺酸形式存在,无色,在被标准滴定溶液氧化时,生成二苯联苯磺酸,紫色。
专用指示剂能和氧化剂还原剂生成特殊色泽,明显提高观测灵敏度,如在碘量法滴定中,可溶性淀粉溶液和碘标准滴定溶液生成深蓝色吸附性化合物,可逆。
自身指示剂如高锰酸钾标准滴定溶液滴定产品草酸时,滴定终点为高锰酸钾标准滴定溶液的紫色。4
预先操作在氧化还原滴定中,往往需要在滴定之前,先将被测组分氧化或还原到一定的价态,然后进行滴定。这一步骤称为预先氧化或还原处理。通常要求预处理时所用的氧化剂或还原剂与被测物质的反应进行完全,反应快,过量的试剂容易除去,并要求反应具有一定的选择性。
试剂判断氧化还原不可分,得失电子是根本。失电子者被氧化,得电子者被还原。
失电子者还原剂,得电子者氧化剂。氧化剂 还原剂,相依相存永不离。5
影响因素氧化还原反应的反应机理往往比较复杂,常伴随多种副反应,或容易引起诱导反应,而且反应速率较低,有时需要加热或加催化剂来加速。这些干扰都需针对具体情况,采用不同的方法加以克服,否则会影响滴定的定量关系。4
本词条内容贡献者为:
李嘉骞 - 博士 - 同济大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国