生物物理基础
生物组织由细胞和细胞间质共同组成,其中细胞间质为具电解液特性的组织液及悬浮理学于其中的大分子化合物构成,可等效为一定阻值的电阻。细胞膜为具有低的漏电特性的绝缘膜,是组织阻抗容性成分的主要贡献者。细胞质与细胞间质相类似,表现为阻性。
对生物体来说,一方面由于细胞种类、排列的疏密、细胞间质及细胞膜通透性的不同,不同组织、甚至于同种组织的不同方向及状态所表现出的阻抗特性都有可能不同;另一方面由于组织的生理或病理改变必然会影响到细胞膜的通透性、细胞间质的电解质浓度等的变化,从而影响到其阻抗特性。
电阻抗断层成像基本原理生物电阻抗断层成像(Electrical Impedance Tomography,简称EIT)是以生物体内电阻抗分布的绝对值(静态EIT)或阻抗的变化量(动态EIT)为成像对象的一种新型成像技术。目前,EIT常采用体表激励、体表测量技术对成像区域的阻抗分布信息进行测量,通过体表电极注入安全、微弱的交变电流(电压),并同步测量边界上的电压(电流),电极数目一般为8、16、32等,均匀放置体表一周,采用轮转驱动电极和测量电极的方式,实现等效四电极阻抗测量,并获得体表不同部位的一帧阻抗数据,利用图象重构算法对阻抗数据进行重构,得到反映体内阻抗分布或变化的断层图像。
静态成像(Static imaging)。静态EIT以测量对象内部电阻(导)率的绝对分布为成像目标,通过对测量目标外加驱动电压或电流测量其边界电压或电流,以估计目标内部电阻(导)率分布的绝对值。
静态EIT技术需要目标表面形状、电极结构和位置的准确信息,微小的误差可能会导致重构结果的发散。因此,静态EIT技术需要很高的测量精度和电极的精确定位,增加了对仪器的许多限制和要求,同时生物结构的各向异性和实际场的三维分布给静态重构算法的收敛带来了困难。由于这些条件的限制,静态EIT技术还处于仿真和物理模型研究阶段。
动态成像(Dynamic imaging)。动态EIT技术以测量对象内部的电阻(导)率分布的变化为求解目标,利用两组测量数据的差值进行成像,去除了测量系统误差,反映了两次测量中阻抗分布的变化情况,相对于静态成像,提高了系统对被测目标形状、电极位置的鲁棒性。因而成为目前能在临床进行应用研究的EIT新技术,取得了初步的临床效果。
总体上,EIT技术具有操作简便、成像速度快、体表无创测量、仪器价格较低、检查费用较低,对人体生理和病理改变引起的阻抗变化敏感的特点和优势。
EIT检测技术EIT检测技术的基本要求是按照应用需求,采用现代电子技术和计算机技术以一定的速度和精度,对成像部位的阻抗信息进行安全和有效检测。目前,常用的是体表交流恒流激励、体表电压测量,通过解调技术获取阻抗信息。图1-1为EIT体表激励和测量基本示意图。

图1-1 EIT体表激励、测量示意图
一个基本的EIT检测系统包括电极模块、交流恒流驱动模块、信号放大和检测模块、数据采集模块、驱动及测量模式设置模块、电源模块及计算机等,完成阻抗数据的采集、传输、存储等功能,供阻抗成像算法调用。
1.电极模块为了使用方便并较好的从体表获取阻抗信息,目前EIT中常用8、16、32个体表电极,尽量均匀的配置在成像部位的一周;在用于三维成像中,电极数最多达到了960个。电极结构为单个电极或复合电极,均采用一对电极激励、另外的一对电极测量的4电极法阻抗测量模式。电极材料一般为医用电极材料,如用于头部的镀金、镀银杯状电极,用于胸腹部的一次性自粘贴心电电极、导电橡胶电极等。对电极的基本要求是能与皮肤稳定、良好接触,对皮肤没有腐蚀或损害,皮肤与电极接触阻抗尽量小。
2.交流恒流驱动模块为了安全,并部分消除电极皮肤接触阻抗的影响,生物阻抗测量大部分采用基于欧姆定律的交流恒流激励(I恒定)、测量体表电位差(V)的方法,通过解调间接获得一对驱动电极与一对测量电极间的等效阻抗。产生一定频率的交流信号,可以采用模拟正弦发生器或直接数字合成技术(DDS),恒流激励输出一般采用压控电流源电路(VCCS),输出电流小于5mA的恒流激励信号,施加到一对驱动电极上。对恒流激励模块的要求是输出阻抗高、噪声小、稳定性好、频率响应好。
3.信号检测模块针对一对测量电极上的体表信号,完成高精度放大、动态范围调整及阻抗信号解调等功能。信号放大通常采用高性能仪表放大器(IA),并满足高输入阻抗、高共模抑制比、低噪声和宽频的需求。
针对EIT中不同测量电极对之间的信号幅值变化较大的实际,在前置放大器之后一般设置程控增益放大器(PGA),调整信号的动态范围,图1所示为一个32电极EIT系统临近驱动临近测量模式的一组数据,最大值与最小值之比达100:1,因此要采用PGA对小信号提供更高的放大倍数,以降低小信号在A/D转换时的量化误差。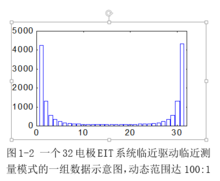
放大后的信号,可以采用模拟或数字解调技术,对被测信号中的阻抗实部、虚部信息(模值或相位)进行解调。常用的模拟解调技术或器件主要有均方值法(RMS)、整流滤波法、开关解调法、模拟乘法器和高速采保解调器等,数字解调就是对被测信号和参考信号进行高速、高精度多点同步采样后,采用数值解调方法对被测信号序列和参考信号序列进行运算,求得被测信号的幅值和相对于参考信号的相位信息。
4.数据采集模块主要完成模拟信号到数字信号的转换功能(A/D)。根据精度和速度的要求,A/D一般要有12位以上的分辨率;若采用模拟解调技术,则A/D的采集速度较低,若采用数字解调技术,则为了提高解调精度,解调数据序列要足够长,在单位周期时间内要求A/D能采集到足够多的数据,采集速度较快才能满足要求。
5.驱动、测量模式设置模块选择多电极中的一对作为恒流激励电极、并选择另外一对电极作为体表响应电压的测量电极。一般选用电子开关,可程控选择任意2个用于激励、任意2个用于信号检测,最常用的激励方式是临近(一对相邻电极)激励和对向(一对径向的相对电极)激励,最常用的测量方式是临近(一对相邻电极)测量。
无论采用何种激励和测量模式,都必须按一定的组合方式和时序将激励信号加载到一对驱动电极上,将一对测量电极上的信号或校准信号(定标信号)加载到信号检测模块的输入端,实现这一功能目前主要采用高速模拟开关(Analog Multiplexer)。要求模拟开关的导通电阻尽量小且一致,通道串扰小、频率响应好、温度特性好、切换速度快。
EIT硬件系统结构1. 硬件系统主要结构从整体结构上,EIT硬件系统分为串行激励、串行测量的串行结构,串行激励、并行测量或并行激励、串行测量的半并行结构,以及并行激励、并行测量的全并行结构。
串行结构的系统,只有单通道激励源和单通道测量模块,在选择不同电极对进行驱动和测量时,要用多路开关进行切换,因此影响了系统的总体测量速度,在成像速度较慢的系统中,可以采用串行结构的系统。其优点是结构简单、费用低、维护方便。
并行结构的系统,有多通道的激励源和测量模块。可以在同一时间向多对电极施加激励,已获得较优激励模式;可以同时测量多对电极上的信号,大大提高测量速度。其不足是结构较复杂、费用高,需要综合考虑通道一致性和稳定性,系统需要定期校准和定标。
半并行结构兼具串行和并行的优势,可以获得较高的速度和较好的性能。
2.硬件系统主要特点尽管EIT硬件系统结构有串行、并行和串并混合型,采用的技术、选用的功能电路和器件各不相同,但高精度和/或高速度是其共同特点。
**高精度。**在电EIT中要求高精度的原因,主要来自临床需要。文献报道,在一个心动周期中,肺部组织因血流改变导致的阻抗变化约为肺组织自身阻抗的3%,在体表电压测量中,仅能测量到这种阻抗变化的5%,即肺部血流灌注引起的阻抗变化在体表能观测到约0.15%的改变,因此胸部EIT中的测量系统要求能至少测量0.1%的变化。在脑部,因为颅骨高电阻率的存在,激励电流中仅有少部分进入颅内,颅内阻抗变化信号经进一步衰减后才能从头皮测到,因此脑EIT的硬件系统,要求其精度更高。仿真研究表明,在脑部EIT中,要能够检测到有临床意义的颅内出血或缺血引起的阻抗变化,脑EIT的阻抗分辨率要至少达到0.01%。由于电路自身噪声、器件的非线性、系统内部串扰、来自外界的干扰及测量误差在实际测量系统中都不同程度的、不可避免的存在,高精度EIT系统是阻抗成像的基础和硬件支撑。
**高速度。**心脏的收缩是体内器官最快的活动之一,在胸部EIT中要动态显示一个完整的心动周期中血流灌注引起的阻抗变化,则成像速度不得低于20帧/秒,考虑到人眼视觉上对动态图像无闪烁感的最低要求,胸部EIT图像动态显示速度理论上应不低于25帧/秒,即硬件系统采集一组数据的时间加上算法使用这组数据重构一幅图像并动态显示的时间应小于40ms。因此,胸部EIT硬件系统应当具有高速度的特性,这是高速成像的前提,在此前提下,还应当有高精度的特性,才能从胸部体表有效检测到血流灌注引起的阻抗变化。
一个典型的阻抗成像检测系统的指标主要有:电极数目16个,激励频率50KHz,激励电流从0.1mA~2.5mA可程控设置,恒流源输出阻抗大于500 KΩ;信号检测模块输入阻抗大于2MΩ,50KHz CMRR大于70dB,R.T.I.小于100μV,测量精度(Sd/Mean)优于0.1%,测量速度每秒15帧数据。
EIT技术因其无创、快速、费用低、操作简便的优势,在脑部、胸部和腹部重要脏器的生理、病理功能变化的快速、动态监测方面,展示了很好的应用前景。
扩展阅读(1) 董秀珍。生物电阻抗成像研究的现状与挑战[J]. 中国生物医学工程学报,2008,05:641-643+649
(2) 徐桂芝,杨硕,李颖,颜威利。电阻抗断层成像技术综述[J]. 河北工业大学学 报,2004,02:35-40.
(3) Brown BH. Cardiac and respiratory related electrical impedance changes in the human thorax. IEEE Trans Biomed Eng.,1994; 41(8):729-733
(4) Robert WM, Smith HJ. A real-time electrical impedance tomography system for clinical use-design and preliminary results. IEEE Trans Biomed Eng., 1995;42(2) 133-140
(5) 史学涛,董秀珍, 帅万钧,尤富生,付峰,刘锐岗。适用于脑部电阻抗断层成像的单源驱动电流模式, 第四军医大学学报, 2006, 27(3): 279-282.
(6) 尤富生,董秀珍,史学涛,付峰,刘锐岗,李江。电阻抗断层成像中临近和对向驱动模式的研究[J].第四军医大学学报,2004,01:88-91.
(7) 尤富生,董秀珍,史学涛,付峰,刘锐岗,秦明新,汤孟兴,李江。生物电阻抗模拟解调技术的研究[J].北京生物医学工程,2004,01:21-23+16。
(8) 尤富生,董秀珍,史学涛,付峰,刘锐岗。多频生物电阻抗高精度模拟解调技术的研究[J].医疗卫生装备,2004,07:10-11.
(9) 尤富生,董秀珍,秦明新,史学涛,付峰,刘锐岗,汤孟兴,李江,吴晓明。电阻抗断层成像中驱动和测量模式程控系统的设计[J].第四军医大学学报,2001,03:273-275.
(10)尤富生,董秀珍,秦明新,史学涛,汤孟兴,刘锐岗。一个32电极电阻抗断层成像硬件系统[J].第四军医大学学报,1998,S1:7-9.
(11)尤富生.电阻抗断层成像硬件系统[J]。国外医学-生物医学工程分册,1998,03:6-11.
(12)颜威利,徐桂芝,等著。生物医学电磁场数值分析[B]。第八章.电阻抗成像装置与系统测试。2006.3,机械工业出版社。
本词条内容贡献者为:
尤富生 - 教授 - 第四军医大学生物医学工程系董秀珍 - 教授 - 第四军医大学生物医学工程系




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国