氢原子即氢元素的原子。氢原子模型是电中性的,原子含有一个正价的质子与一个负价的电子,他们被库仑定律束缚于原子内。氢只有三种同位素:氕(P)原子核内有1个质子,无中子,丰度为99.98%;氘(D)(又叫重氢) ,原子核内有1个质子,1个中子,丰度0.016%;氚(T)(又叫超重氢),原子核内有1个质子,2个中子,丰度0.004%。
历史1913 年,尼尔斯·玻耳在做了一些简化的假设后,计算出氢原子的光谱频率。这些假想,玻尔模型的基石,并不是完全的正确,但是可以得到正确的能量答案。1
1925/26 年,埃尔文·薛定谔应用他发明的薛定谔方程,以严谨的量子力学分析,清楚地解释了玻尔答案正确的原因。氢原子的薛定谔方程的解答是一个解析解,也可以计算氢原子的能级与光谱谱线的频率。薛定谔方程的解答比玻尔模型更为精确,能够得到许多电子量子态的波函数(轨道),也能够解释化学键的各向异性。
简介氢原子是氢元素的原子。电中性的原子含有一个正价的质子与一个负价的电子,被库仑定律束缚于原子核内。在大自然中,氢原子是丰度最高的同位素,称为氢,氢-1,或氕。氢原子不含任何中子,别的氢同位素含有一个或多个中子。这条目主要描述氢-1 。2
氢原子拥有一个质子和一个电子,是一个的简单的二体系统。系统内的作用力只跟二体之间的距离有关,是反平方有心力,不需要将这反平方有心力二体系统再加理想化,简单化。描述这系统的(非相对论性的)薛定谔方程有解析解,也就是说,解答能以有限数量的常见函数来表达。满足这薛定谔方程的波函数可以完全地描述电子的量子行为。因此可以这样说,在量子力学里,没有比氢原子问题更简单,更实用,而又有解析解的问题了。所推演出来的基本物理理论,又可以用简单的实验来核对。所以,氢原子问题是个很重要的问题。
另外,理论上薛定谔方程也可用于求解更复杂的原子与分子。但在大多数的案例中,皆无法获得解析解,而必须藉用电脑(计算机)来进行计算与模拟,或者做一些简化的假设,方能求得问题的解析解。
电子轨道图右图显示出能量最低的几个氢原子轨道(能量本征函数)。横向展示不同的角量子数 (l) ,竖向展示不同的能级 (n) 。
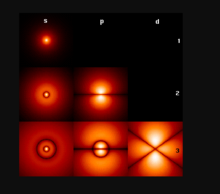 这些是概率密度的截面的绘图。图内各种颜色的亮度代表不同的概率密度(黑色:0 概率密度,白色:最高概率密度)。角量子数 l ,以通常的光谱学代码规则,标记在每一个纵排的最上端。s 意指l=0,p 意指 l=1 ,d意指 l=2。主量子数
这些是概率密度的截面的绘图。图内各种颜色的亮度代表不同的概率密度(黑色:0 概率密度,白色:最高概率密度)。角量子数 l ,以通常的光谱学代码规则,标记在每一个纵排的最上端。s 意指l=0,p 意指 l=1 ,d意指 l=2。主量子数 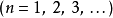 标记在每一个横排的最右端。磁量子数m被设定为 0 。截面是 xz-平面( z-轴是纵轴)。将绘图绕着 z-轴旋转,则可得到三维空间的概率密度。
标记在每一个横排的最右端。磁量子数m被设定为 0 。截面是 xz-平面( z-轴是纵轴)。将绘图绕着 z-轴旋转,则可得到三维空间的概率密度。
基态是最低能级的量子态,也是电子最常找到的量子态,标记为1s态,n=1, l=0}。
特别注意,在每一个轨道的图片内,黑线出现的次数。这些二维空间黑线,在三维空间里,是节面(nodal plane) 。节面的数量等于 n-1},是径向节数( n-l-1 )与角节数( l )的总和。
稳定性思考氢原子稳定性问题,应用经典电动力学来分析,则由于库仑力作用,束缚电子会被原子核吸引,呈螺线运动掉入原子核,同时辐射出无穷大能量,因此原子不具有稳定性。但是,在大自然里这虚拟现象实际并不会发生。那么,为什么氢原子的束缚电子不会掉入原子核里?应用量子力学,可以计算出氢原子系统的基态能量大于某有限值,称这结果为满足“第一种稳定性条件”,即氢原子的基态能量E0大于某有限值:
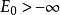
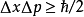 量子力学的海森堡不确定性原理可以用来启发性地说明这问题,电子越接近原子核,电子动能越大。但是海森堡不确定性原理不能严格给出数学证明,有些特别案例不能满足第一种稳定性条件,因为{\displaystyle \Delta x}量度的是波函数的半宽度,而不是波函数集聚于原子核附近的程度,所以波函数可以拥有一定的半宽度,并且极度集聚于原子核附近,造成库仑势能趋于
量子力学的海森堡不确定性原理可以用来启发性地说明这问题,电子越接近原子核,电子动能越大。但是海森堡不确定性原理不能严格给出数学证明,有些特别案例不能满足第一种稳定性条件,因为{\displaystyle \Delta x}量度的是波函数的半宽度,而不是波函数集聚于原子核附近的程度,所以波函数可以拥有一定的半宽度,并且极度集聚于原子核附近,造成库仑势能趋于 ,同时维持有限的动能。
,同时维持有限的动能。
更详细分析起见,只考虑类氢原子系统,给定原子的原子序Z ,原子的能量 E为
 其中, T 为动能,V为势能,
其中, T 为动能,V为势能, 为描述类氢原子系统的波函数, x为位置坐标,
为描述类氢原子系统的波函数, x为位置坐标, 为积分体积。
为积分体积。
应用索博列夫不等式,经过一番运算,可以得到能量最大下界为。
 其中, Ry是能量单位里德伯,大约为13.6eV。
其中, Ry是能量单位里德伯,大约为13.6eV。
总结,类氢原子满足第一种稳定性条件这结果。
表格比较
|| ||
参阅氘
氚
氢原子光谱
21公分线
量子化学
类氢原子
球对称位势
拉普拉斯-龙格-楞次矢量
本词条内容贡献者为:
杜强 - 高级工程师 - 中国科学院工程热物理研究所




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国