原理
铝热剂是把铝粉和高熔点金属氧化物(如三氧化二铁粉末)按比例配成的混合物, 使用时加入氧化剂点燃,反应激烈进行,得到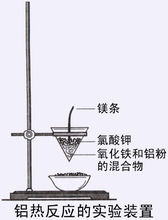 氧化铝和单质并放出大量的热,温度可到约2500℃,能使生成的单质熔化。这个反应叫做铝热反应。铝热反应原理可以应用在生产上,例如焊接钢轨等。用某些金属氧化物(如V2O5、Cr2O3、MnO2等)代替氧化铁,也可以做铝热剂。当铝粉跟这些金属氧化物反应时,产生足够的热量,使被还原的金属在较高温度下呈熔融状态,跟形成的熔渣分离开来,从而获得较纯的金属。在工业上常用这种方法冶炼难熔的金属,如钒、铬、锰等。利用的是铝被氧化时放热。
氧化铝和单质并放出大量的热,温度可到约2500℃,能使生成的单质熔化。这个反应叫做铝热反应。铝热反应原理可以应用在生产上,例如焊接钢轨等。用某些金属氧化物(如V2O5、Cr2O3、MnO2等)代替氧化铁,也可以做铝热剂。当铝粉跟这些金属氧化物反应时,产生足够的热量,使被还原的金属在较高温度下呈熔融状态,跟形成的熔渣分离开来,从而获得较纯的金属。在工业上常用这种方法冶炼难熔的金属,如钒、铬、锰等。利用的是铝被氧化时放热。
目前国外的固体火箭燃料也有使用铝热反应的原理。
教材上对铝热剂的叙述有两处,其一是说“通常把铝粉和氧化铁的混合物叫铝热剂”,其二是讲“用某些金属氧化物(如V2O5,Cr2O3,MnO2等)代替氧化铁也可以做铝热剂”。即可以发生铝热反应的混合物称之为铝热剂。这就是说明作为铝热剂重要组成的金属氧化物,并非泛指所有金属氧化物,而是有—定范围的,即指那些难熔的金属氧化物。而这些难熔的金属氧化物和混合物中的铝反应时放出大量热,也是构成铝热反应的一个重要条件。
有些金属氧化物,不能与铝反应,或放出的热不多,均不能做铝热剂使用。
历史德国化学家汉斯·歌德史密斯(Hans Goldschmidt)于1893年发明铝热法并于两年后申请专利。1因此该反应也被称为“歌德史密斯法”或“歌德史密斯过程”。研究最初的目的是在不用碳熔炼的条件下制备高纯度金属,但歌德史密斯敏锐的发现铝热法可以用于焊接。21899年在德国埃森,铝热法首次商业应用于焊接铁轨。
引燃铝热反应需要高温来引发,可在混合物粉末上插一根镁条做引信(可混入适量氯酸钾帮助镁条燃烧,高锰酸钾、硝酸钾等氧化剂也可助燃;过氧化钡也可,但烟有毒)。高锰酸钾和甘油的混合物缓慢放热,也可以做引发剂(高锰酸钾和葡萄糖的混合物亦可,点燃后剧烈反应并引发铝热反应)。丙烷枪也可以提高引发反应所需的高温。反应开始后会剧烈放热,火花四溅,温度极高,所以点火时要注意安全。
常见种类铝热剂中最常用的氧化铁/铝,345磁铁矿也工作。偶尔使用其他氧化物,例如锰铝热剂 ,铬铝热剂 ,硅热剂,或铜铝热剂,但仅用于专门目的。 所有这些实施例使用铝作为反应性金属。含氟聚合物可用于特殊配方中, 特氟隆与镁或铝是相对常见的实例。6
干冰和还原剂如镁,铝和硼的组合遵循与传统铝热剂混合物相同的化学反应,产生金属氧化物和碳。 尽管干冰铝膏混合物的非常冷的温度,但是这种系统能够用火焰点燃。当细分状干冰铝热剂被传统炸药一样限制在管中点燃时,将会爆炸,并且反应中释放的一部分碳以金刚石的形式出现。
原则上,可以使用任何活性金属代替铝。但是铝的性质对于该反应几乎是理想的:
它是迄今为止最便宜的高反应性金属。
它形成钝化层,使其比许多其他活性金属更安全。7
其相对低的熔点 (660℃)意味着易于熔融金属,使得反应主要在液相中发生,因此相当快地进行。
其高沸点 (2519℃)使得反应达到非常高的温度,因为几个过程倾向于将最高温度限制到刚好低于沸点。 这种高沸点在过渡金属(例如,分别在2887℃和2582℃下沸腾的铁和铜)中是常见的,但是在高反应性金属(沸点:镁1090℃和钠883℃)中并不常见。
此外,由于反应形成的氧化铝的低密度趋于使其漂浮在所得纯金属上。 这对于减少焊缝中的污染是特别重要的。
尽管反应物在室温下是稳定的,但当它们被加热至着火温度时,它们以极强烈的放热反应燃烧。 由于达到高温(高达2500°C,使用氧化铁(III)),产品表现为液体 - 虽然达到的实际温度取决于热量能够快速逃逸到周围环境。 铝热剂有自己的氧气供应,不需要任何外部空气源。 因此,在给定足够的初始热的情况下,其不能被窒息并且可以在任何环境中点燃。 它会在湿润时燃烧良好,不能用水轻易熄灭,虽然足够的水会除去热量并可能停止反应。 少量的水在达到反应前会沸腾。 即使如此,铝热剂也用于水下焊接。8
该铝合金的特征在于在燃烧期间几乎完全没有气体产生,反应温度高。 燃料应具有高的燃烧热并产生具有低熔点和高沸点的氧化物。 氧化剂应当包含至少25%的氧,具有高密度,低形成热,并且产生具有低熔点和高沸点的金属(因此释放的能量不会在反应产物的蒸发中消耗)。 可以向组合物中加入有机粘合剂以改善其机械性能,然而它们倾向于产生吸热分解产物,导致反应热的一些损失和气体的产生。9
反应期间达到的温度决定结果。 在理想情况下,反应产生充分分离的金属和炉渣的熔体。 为此,温度必须足够高以熔化反应产物,所得金属和燃料氧化物。 太低的温度将导致烧结金属和炉渣的混合物,太高的温度 - 高于任何反应物或产物的沸点 - 将导致气体的快速产生,分散燃烧的反应混合物,有时甚至爆炸。可以通过添加合适的氧化剂来提高太低的反应温度(例如当从砂生产硅时),通过使用合适的冷却剂和/或熔渣流量可以降低太高的温度 。 通常在使用的助熔剂是氟化钙,因为其仅最低限度地反应,具有相对低的熔点,在高温下的低熔体粘度(因此增加炉渣的流动性)并与氧化铝形成共晶体。 然而,过多的助熔剂将反应物稀释至不能维持燃烧的程度。 金属氧化物的类型也对产生的能量的量具有显着的影响; 氧化价越高,产生的能量越高。 一个好的实例是氧化锰(IV)和氧化锰(II)之间的差异 ,其中前者产生太高的温度,后者几乎不能维持燃烧; 为了获得良好的结果,应该使用具有适当比例的两种氧化物的混合物。
反应速率也可以用粒径调节; 较粗的颗粒比较细的颗粒燃烧得慢。 该效果对于需要加热至较高温度以开始反应的颗粒更显显著。
在绝热条件下 ,当没有热量损失到环境中时,在反应中实现的温度可以使用赫斯定律来估计 - 通过计算由反应本身产生的能量(从产物的焓中减去反应物的焓)并减去加热产品所消耗的能量(根据它们的比热,当材料仅改变它们的温度时,以及它们的熔化焓和当材料熔化或沸腾时的最终蒸发焓 )。 在实际条件下,反应对环境失去热量,因此实现的温度略低。 传热速率是有限的,因此反应越快,越接近其运行的绝热条件,并且实现的温度越高。10
铁铝热剂最常见的组合物是铁铝热剂。 所用的氧化剂通常是三氧化二铁或四氧化三铁 。 前者产生更 多的热量。 后者更容易点燃,可能是由于氧化物的晶体结构。 添加铜或锰氧化物可以更容易点燃。9
多的热量。 后者更容易点燃,可能是由于氧化物的晶体结构。 添加铜或锰氧化物可以更容易点燃。9
铜铝热剂铜铝热剂可以使用氧化亚铜或氧化铜来制备。 燃烧速率非常快,并且铜的熔点相对低,因此反应在非常短的时间内产生大量的熔融铜。 铜(II)铝热反应可能如此之快,以致于铜铝热剂可以被认为是一种闪光粉末 。 可能发生爆炸,并发送铜滴喷雾到相当远的距离。
铜(I)铝热剂具有工业用途,例如焊接厚铜导体(“ 焊接 ”)。 这种焊接也被用于电缆拼接。
铝热燃烧剂铝热燃烧剂是盐基氧化剂(通常是硝酸盐例如硝酸钡,或过氧化物)的铝热剂。 与常规铝热剂相比,铝热燃烧剂燃烧时有火焰和气体的放出。 氧化剂的存在使得混合物更容易点燃并改善燃烧物对靶的渗透,因为放出的气体喷射熔融炉渣并提供机械搅拌。这种机制使得铝热燃烧剂用于燃烧目的和用于敏感设备(例如密码设备)的紧急破坏的热固性材料更适合,因为铝热剂的效应更局部化。
应用铝热反应过程中放出的热可以使高熔点金属熔化并流出,故铝热法广泛运用于焊接抢险工程,例如将铁轨连接成一段长轨即使用此法。另外,铝热法也是冶炼钒、铬、锰等高熔点金属的重要手段。
铝热剂除了焊轨、冶炼难熔金属以外,在军事上也有广泛的应用,例如在炮弹头—咀装进铝热剂成分,因为反应温度极高,用于制作燃烧弹,可熔穿装甲,极大地提高杀伤力。在前苏联科学家编写的《火箭炮》一书中,谈到火箭炮弹头装药就有铝热剂的成分。
在中国人民革命军事博物馆里,展品中就有美军的钢盔、卡宾枪被烧熔在一起,除了火箭弹以外,其它炸弹没有如此大的能量。
除此之外,其他的单质与金属氧化物混合之后点燃,也会发生强烈的氧化还原反应,效果类似于铝热反应。其中的单质可以是铝、镁、钙、钛、硅、硼——并不仅限于金属,而金属氧化物可以是三氧化二硼、二氧化硅、三氧化二铬、二氧化锰、三氧化二铁、四氧化三铁、氧化铜和四氧化三铅等。有时这些反应也根据反应中的还原剂而称为“镁热法”、“硅热法”、“钙热法”、“碳热法”等等。
综上所述,只有满足上面条件的一些氧化物与铝粉组成混合物方可称为铝热剂。
应用1、置换金属
2、焊接金属
3、军事上可以制作铝热弹等强杀伤性武器
4、燃料




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国