介绍
符号Am,原子序数95。原子量243,比重11.7,银白色金属。为人工获得的放射性元素,具强放射性,化学性质活泼,是同位素测厚仪和同位素X荧光仪等的放射源。
已发现镅有从质量数237到247的13种同位素。最重要的镅同位素是Am和43Am,它们都是α放射体,半衰期分别为458a和7370a。
镅是银白色金属,熔点1267K,沸点2880K,密度(273K)为13670kg/m。镅原子的电子构型为〔Rn〕5f 7s。金属镅易被稀酸溶解。镅在水溶液中以+2~+7六种价态存在,其中以Am为最稳定。6
发现简史 名称由来:模仿铕的命名法,用美洲大陆的名字“America”为镅命名。
名称由来:模仿铕的命名法,用美洲大陆的名字“America”为镅命名。
发现人:西博格(G.T.Seaporg)、詹姆斯(R.A.Jamse)和摩根(L.O.Morgan)
发现年代:1944年
地点: 美国
发现过程:1944年,由美国西博格、詹姆斯和摩根在被一个反应堆辐射过的钚中发现的。
物理性质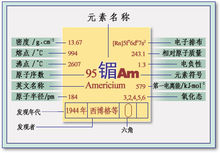 熔点994±4℃,沸点2607℃,密度11.7克/立方厘米。六方型银白色金属,有光泽;延展性较铀和镎为好。空气中逐渐变暗。溶于稀酸。在稀硫酸或稀硝酸溶液中,可被过二硫酸盐氧化为AmO22+盐,溶液呈深黄色。镅以+3价为最稳定,但同时也有+4,+6价化合物。有氧化物、氢氧化物、氟化物和氯化物等。同位素243Am半衰期为7.95×103年;另一种同位素241Am半衰期为458年。
熔点994±4℃,沸点2607℃,密度11.7克/立方厘米。六方型银白色金属,有光泽;延展性较铀和镎为好。空气中逐渐变暗。溶于稀酸。在稀硫酸或稀硝酸溶液中,可被过二硫酸盐氧化为AmO22+盐,溶液呈深黄色。镅以+3价为最稳定,但同时也有+4,+6价化合物。有氧化物、氢氧化物、氟化物和氯化物等。同位素243Am半衰期为7.95×103年;另一种同位素241Am半衰期为458年。
相对原子质量: 243.061 常见化合价: +2,+3,+4,+5,+6 电负性: 1.3
外围电子排布: 5f7 7s2 核外电子排布: 2,8,18,32,25,8,2
同位素及放射线: Am-240[2.1d] Am-241[432.7y] Am-242[16h] Am-242m[141y] Am-243(放 α[7370y]) Am-244[10.1h] Am-245[2.1h] Am-246[39.0m]电子亲合和能: 0 KJ·mol-1
第一电离能: 578 KJ·mol-1 第二电离能: 0 KJ·mol-1 第三电离能: 0 KJ·mol-
原子半径: 0 埃 离子半径: 埃 共价半径: 0 埃
元素原子量:[243]
元素类型:金属
原子体积:(立方厘米/摩尔):17.85元素描述:银白灰色的放射性自然非金属元素。
晶体结构:晶胞为六方晶胞。
晶胞参数:
a = 346.81 pm
b = 346.81 pm
c = 1124.1 pm
α = 90°
β = 90°
γ = 120°
状态:人造放射性金属。
地质数据:
太阳(相对于 H=1×1012): 未知 海水中/p.p.m.:零
地壳/p.p.m.: 零 大西洋表面: 太平洋表面:
大气/p.p.m.(体积): 大西洋深: 太平洋深处:
化学性质 氧化态:
氧化态:
Main Am+3
Other Am+2, Am+4, Am+5, Am+6
**三氟化镅(americium trifluoride):**化学式AmF_31,分子量300.12。粉红色粉末,具强α放射性。比重9.53,熔点1393±20℃。和LaF_3结构相似。在空气中极稳定。可由氟氧化镅或二氧化镅在600-700℃的氟化氢气流中反应1小时,或将三氯化镅与氟化铵按下式进行复分解反应制得。可用于还原制取金属镅。
生物数据:
人体中含量
肝/p.p.m.:
器官中: 零 肌肉/p.p.m.:
血/mg dm-3 : 日摄入量/mg: 零
骨/p.p.m.: 人(70Kg)均体内总量/mg: 零
制备方法 镅首先合成的是镅241,是用中子轰击钚239产生的。
镅首先合成的是镅241,是用中子轰击钚239产生的。
用中子轰击钚原子可制得镅。
在1000~1200℃用钡还原三氟化镅而制得。
制取镅有两种途径:一种是从经过长期存放的高燃耗的钚(含有大量Pu)中提取;另一种是在核燃料后处理工厂的废液中提取。前者得到的主要是Am,后者含有Am。可采用离子交换色层分离(见稀土元素色层分离),以磷酸三丁酯(TBP)或噻吩甲酰三氟丙酮(TTA)为萃取剂的溶剂萃取法进行镅的分离和提纯。
2Am是制备锔-242的原料。锔-242用于制作放射性核电池和生产钚-238。用Am制成的低能γ射线源,广泛用于测厚仪、湿度计和能量色散X射线荧光分析用的激发源。Am的α射线源是火灾自动报警器的主要部件,用它可制得性能良好的Am-Be中子源。Am是生产锔和锎-252的原料。目前全世界镅的存贮量为几十公斤。
应用领域镅241应用于烟雾CBE探测器。镅-铍中子源,也用于薄板测厚仪、温度计、火灾自动报警仪及医学上。是同 位素测厚仪和同位素X荧光仪的常用放射源; 还用作制备96Cm的反应堆靶子。 95Am是制造其他超铀元素的靶材料。镅与铍的化合物用作中子源可代替常用的镭 -铍中子源。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国