血红蛋白又称血色素,是红细胞的主要组成部分,能与氧结合,运输氧和二氧化碳,所以在血液气体运输方面Hb占极为重要的地位。12此外,血红蛋白含量还能很好地反映贫血程度。1
正常范围男性 130~175 g/L(13.0-17.5 g/dl);
女性 115~150 g/L(11.5-15.0 g/dl);
新生儿 170~200 g/L(17.0-20.0 g/dl)。1
临床意义血红蛋白增高、降低的临床意义基本和红细胞计数的临床意义相似,但血红蛋白能更好地反映贫血的程度。
血红蛋白增多有以下情况:
生理性增多:见于高原居民、胎儿和新生儿,剧烈活动、恐惧、冷水浴等。
病理性增多:见于严重的先天性及后天性心肺疾患和血管畸形,如法氏四联症、发绀型先天性心脏病、阻塞性肺气肿、肺源性心脏病、肺动脉瘘或肺静脉瘘及携氧能力低的异常血红蛋白病等;也见于某些肿瘤或肾脏疾病,如肾癌、肝细胞癌、肾胚胎瘤及肾盂积水、多囊肾等。1
血红蛋白减少见于以下情况:
生理性减少:3个月的婴儿至15岁以前的儿童,主要因生长发育迅速而致的造血系统造血的相对不足,一般可较正常人的低10%-20%。妊娠中期和后期由于妊娠血容量增加而使血液被稀释,老年人由于骨髓造血功能逐渐降低,可导致红细胞和血红蛋白含量减少。
病理性减少:
骨髓造血功能衰竭,如再生障碍性贫血、骨髓纤维化所伴发的贫血;
因造血物质缺乏或利用障碍所致的贫血,如缺铁性贫血、叶酸及维生素B12缺乏所致的巨幼细胞性贫血;
因红细胞膜、酶遗传性的缺陷或外来因素所致红细胞破坏过多而导致的贫血,如遗传性球形红细胞增多症、海洋性贫血、阵发性睡眠性血红蛋白尿、异常血红蛋白病、免疫性溶血性贫血、心脏体外循环的大手术或某些生物性和化学性等因素所致的溶血性贫血以及某些急性或慢性失血所致的贫血。1
分子结构血红蛋白化学式为C3032H4816O812N780S8Fe4,3每1个血红蛋白分子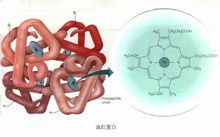 由1个珠蛋白和4个血红素(又称亚铁原卟啉)组成。每个血红素又由4个吡咯基组成一个环,中心为一铁原子。每个珠蛋白有4条多肽链,每条多肽链与1个血红素连接构成Hb的单体或亚单位。Hb是由4个单体构成的四聚体。不同Hb分子的珠蛋白的多肽链的组成不同。成年人Hb(HbA)的多肽链是2条α链和2条β链,为α2β2结构。胎儿Hb(HbF)是2条α链和2条γ链,为α2γ2结构。出生后不久HbF即为HbFA所取代。多肽链中氨基酸的排列顺序已经清楚。每条α链含141个氨基酸残基,每条β链含146个氨基酸残基。血红素的Fe2+均连接在多肽链的组氨基酸残基(His 8)上,这个组氨酸残基若被其它氨基酸取代,或其邻近的氨基酸有所改变,都会影响Hb的功能。可见蛋白质结构和功能密切相关。2
由1个珠蛋白和4个血红素(又称亚铁原卟啉)组成。每个血红素又由4个吡咯基组成一个环,中心为一铁原子。每个珠蛋白有4条多肽链,每条多肽链与1个血红素连接构成Hb的单体或亚单位。Hb是由4个单体构成的四聚体。不同Hb分子的珠蛋白的多肽链的组成不同。成年人Hb(HbA)的多肽链是2条α链和2条β链,为α2β2结构。胎儿Hb(HbF)是2条α链和2条γ链,为α2γ2结构。出生后不久HbF即为HbFA所取代。多肽链中氨基酸的排列顺序已经清楚。每条α链含141个氨基酸残基,每条β链含146个氨基酸残基。血红素的Fe2+均连接在多肽链的组氨基酸残基(His 8)上,这个组氨酸残基若被其它氨基酸取代,或其邻近的氨基酸有所改变,都会影响Hb的功能。可见蛋白质结构和功能密切相关。2
本词条内容贡献者为:
江松敏 - 副教授 - 复旦大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国