肌球蛋白(myosin),又称为肌凝蛋白,是真核细胞内的一类ATP依赖型分子马达,对细胞的运动与细胞内物质传输起着重要的作用。例如肌凝蛋白II就在肌肉收缩和细胞分裂的过程中扮演了重要的角色。其他种类的肌凝蛋白也有着类似的功能。这个蛋白质一开始被描述成一种同时存在于平滑肌和横纹肌中的ATP酶。后来经过Pollarg和Korn的对于棘变形虫属体内类肌凝蛋白功能的研究才发现,许多真核细胞存在同源蛋白基因。证实此类蛋白质的用途不仅仅存在于肌肉细胞中。
其分子形状如豆芽状,由两条重链和多条轻链构成。两条重链的大部分相互螺旋形地缠绕为杆状,构成豆芽状的杆;重链的剩余部分与轻链一起,构成豆芽的瓣。被激活后,具有活性的、能分解ATP的ATP酶。其分子量约为51万。在粗丝中,都是分子的头朝向粗丝的两端,呈纵向线性缔合排列1。
简介肌肉的主要组成蛋白质,占肌原纤维总蛋白质的60%,分子量约51万,是150毫微米长的棒状分子,一端有两个头部。由两条分子量约20万的H链和四条分子量约1万7千到2万5千的L链组成。用蛋白分解酶处理可分割为头部(H-酶解肌球蛋白)和尾部(L-酶解肌球蛋白)。在0.6M KCl溶液中分散成单体,但在0.2M以下的KCl溶液中可形成缔合体,自动聚集成1―2微米长的和A丝相似的结构。在肌原纤维内形成长1.5微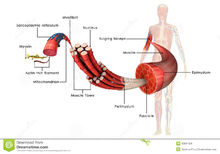 米宽10―15毫微米的A丝。头部向外侧突出架成桥。头部的方向表现为钳在丝的中央部而向相反的方向伸展,结果可以在丝的中央部300毫微米处看到没有头部的裸露部分。头部在A丝上每弯14.3毫微米就移出120°和I丝对应,周期为42.9毫微米。肌球蛋白具有ATP酶活性,在低离子强度下,和肌动蛋白反应,而引起超沉淀,且肌动蛋白能促进ATP酶活性。ATP酶活性和肌动蛋白的反应,表现于头部的活性基团,可以认为这一部分一面分解ATP,一面进行振头活动,把I丝拉向A丝的中央部。肌球蛋白的L链对ATP酶活性具有重要的作用(参见肌球蛋白L链)。肌球蛋白和肌动蛋白一起被认为与全部细胞运动有关,也可从脑、粘菌、海胆卵等分离出来。
米宽10―15毫微米的A丝。头部向外侧突出架成桥。头部的方向表现为钳在丝的中央部而向相反的方向伸展,结果可以在丝的中央部300毫微米处看到没有头部的裸露部分。头部在A丝上每弯14.3毫微米就移出120°和I丝对应,周期为42.9毫微米。肌球蛋白具有ATP酶活性,在低离子强度下,和肌动蛋白反应,而引起超沉淀,且肌动蛋白能促进ATP酶活性。ATP酶活性和肌动蛋白的反应,表现于头部的活性基团,可以认为这一部分一面分解ATP,一面进行振头活动,把I丝拉向A丝的中央部。肌球蛋白的L链对ATP酶活性具有重要的作用(参见肌球蛋白L链)。肌球蛋白和肌动蛋白一起被认为与全部细胞运动有关,也可从脑、粘菌、海胆卵等分离出来。
肌球蛋白(myosin)是沿着肌动蛋白丝轨道运动的分子马达超大家族,最初是由Kuehne在1864年研究骨骼肌收缩时发现并命名的。在最初试图要寻找非肌肉肌球蛋白,首先发现了单头肌球蛋白,随后是传统的双头肌球蛋白。后来,将前者称为“肌球蛋白I”,后者“肌球蛋白Ⅱ”。从此之后,根据发现的时间顺序用罗马数字给肌球蛋白命名,真核细胞中的肌球蛋白可以分为从I到XXXV的35类肌球蛋白种类。

依据来源,可以将肌球蛋白分为两类:传统的肌球蛋白和非传统的肌球蛋白。传统的肌球蛋白指那些构成肌肉的肌球蛋白,也就是肌球蛋白I,最早发现于动物细胞的肌肉组织和细胞质中,主要为肌肉收缩提供驱动力,能够把ATP水解释放出来的化学能转化为肌肉收缩的机械能。但是非肌肉细胞中也存在肌球蛋白Ⅱ,称为非肌肉肌球蛋白Ⅱ。非传统的肌球蛋白指的是那些肌肉中不含有的肌球蛋白,如肌球蛋白I、Ⅲ、ⅣV、V,等只存在于非肌肉细胞之中;肌球蛋白VⅢ,Ⅺ和xⅡ只存在于植物当中。2
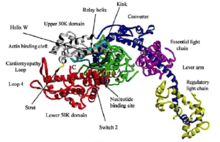
肌球蛋白的结构不管肌球蛋白的来源如何,其基本结构是由一条或两条重链和几条轻链组成。在一般情况下,肌球蛋白是由三个结构域:马达域,颈部和尾部构成。
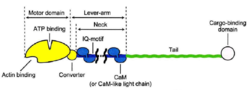
马达域肌球蛋白的头部,分子量为80kDa,通常位于氨基末端。在所有的肌球蛋白种类中,马达域的核心序列是高度保守的。不同的肌球蛋白马达域的结构是非常相似的,由多个α螺旋包围的7个β折叠链组成。马达域包含两个重要的结合位点:核苷酸结合位点和肌动蛋白结合位点。肌动蛋白结合位点被深裂口分开,根据ATP的结合与否而开或关。ATP结合位点由一个P环构成,类似于驱动蛋白,说明肌动蛋白和驱动蛋白的运动有一个相似的与ATP有关的构象变化机制。
颈部肌球蛋白的颈部由一个长的α螺旋构成,携带1到6个特有的IQ模体。这些IQ模体有致的钙调蛋白结合序列(QXXXRGXXXR),每个IQ模体都含有一个钙调蛋白或钙调蛋白家族成员的结合位点,颈部区域通过结合钙调蛋白或相关的轻链而得以稳定,且能够传导和放大马达域受ATP影响的构象变化,在ATP水解后,产生动力冲程,所以有时颈部也被称为杆臂。不同的肌球蛋白,颈部长度不同。肌球蛋白Ⅴ颈部比较长,约24mm,大约是肌球蛋白Ⅱ的3倍长
尾部肌球蛋白的尾部通常位于羧基末端,是一个超螺旋结构,其序列、长度、域成分和组织极其易变。肌球蛋白之间最本质的区别在于球状尾部。尾部含有为不同的“货物”提供的特定结合位点。这一结构域通过直接作用或通过接头蛋白来识别各种“货物”,决定肌球蛋白的细胞定位(靶向)和功能。2
性能介绍性质肌球蛋白属球蛋白类,不溶于水而溶于0.6mol/ml的KCl或NaCl溶液。它具有酶活性,通过与肌动蛋白相互作用,水解ATP的末端磷酸基团,同时也能水解GTP、CTP等,将化学能转化为机械能,从而产生各种形式的运动。物理化学研究表明,肌球蛋白溶液加入ATP后,其粘度和流动双折射显著下降。后来证实这是由于肌动蛋白与肌球蛋白复合物的分解,形成两种轴比较小的蛋白质分子而引起。
功能肌球蛋白作为细胞骨架的分子马达,是一种多功能蛋白质,其主要功能是为肌肉收缩提供力。纤丝滑动学说(sliding filament theory)认为肌肉收缩是由于肌动蛋白细丝与肌球蛋白丝相互滑动的结果。在肌肉收缩过程中,粗丝和细丝本身的长度都不发生改变,当纤丝滑动时,肌球蛋白的头部与肌动蛋白的分子发生接触(attachment)、转动(tilting),最后脱离(detachment)的连续过程,其结果使细丝进行相对的滑动。
肌球蛋白也广泛存在于非肌细胞中,它是细胞骨架的组成成分,为细胞质流动、细胞器运动、物质运输、有丝分裂、胞质分裂和细胞的顶端生长等提供所需的力,参与细胞的吞噬、运动、受精和吸收 等生理过程,充当非肌细胞生命活动的不同层次的调节者,从简单的细胞间的信号传递到指导向化性迁移和细胞形状的改变等较高级的调节。研究表明,肌球蛋白为盘基网柄菌在振荡培养下正常生长和分裂、表面蛋白受体成帽(surface receptor capping)、多细胞发育成子实体(fruiting body)、细胞与器壁的脱粘附(adherence)等生命活动所必需[6]。阎隆飞等在80年代的研究结果表明,肌球蛋白在高等植物如黄瓜等花粉管伸长和豌豆叶片卷须运动中可能执行重要功能。Kinkema等(1994)证明植物肌球蛋白在植物生长发育的不同时期及不同部位有不同的生理功能3。
等生理过程,充当非肌细胞生命活动的不同层次的调节者,从简单的细胞间的信号传递到指导向化性迁移和细胞形状的改变等较高级的调节。研究表明,肌球蛋白为盘基网柄菌在振荡培养下正常生长和分裂、表面蛋白受体成帽(surface receptor capping)、多细胞发育成子实体(fruiting body)、细胞与器壁的脱粘附(adherence)等生命活动所必需[6]。阎隆飞等在80年代的研究结果表明,肌球蛋白在高等植物如黄瓜等花粉管伸长和豌豆叶片卷须运动中可能执行重要功能。Kinkema等(1994)证明植物肌球蛋白在植物生长发育的不同时期及不同部位有不同的生理功能3。
本词条内容贡献者为:
江松敏 - 副教授 - 复旦大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国