革兰氏染色(Gram Staining)是用来鉴别细菌的一种方法:这种染色法利用细菌细胞壁上的生物化学性质不同,可将细菌分成两类,即革兰氏阳性(Gram Positive)与革兰氏阴性(Gram Negative)。这一染色方法由丹麦医生汉斯·克里斯蒂安·革兰于1884年所发明,最初是用来鉴别肺炎球菌与克雷白氏肺炎菌之间的关系,后推广为鉴别细菌种类的重要特性之一,对由细菌感染引起的疾病的临床诊断及治疗有着广泛用途。
简介革兰氏染色法是细菌学中广泛使用的一种鉴别染色法,这种染色法是由一位丹麦医生汉斯·克里斯蒂安·革兰(Hans Christian Gram,1853年-1938年)于1884年所发明,最初是用来鉴别肺炎球菌与克雷白氏肺炎菌之间的关系。
未经染色之细菌,由于其与周围环境折光率差别甚小,故在显微镜下极难观察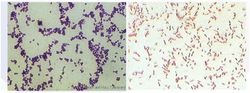 。染色后细菌与环境形成鲜明对比,可以清楚地观察到细菌的形态、排列及某些结构特征,而用以分类鉴定。
。染色后细菌与环境形成鲜明对比,可以清楚地观察到细菌的形态、排列及某些结构特征,而用以分类鉴定。
相关致病菌与抗菌药选择
革兰氏阳性菌:葡萄球菌属(主要是金黄色葡萄球菌、表皮葡萄球菌等)、链球菌属(肺炎链球菌、草绿色链球菌、肠球菌等)、白喉杆菌、炭疽杆菌、破伤风杆菌、蜡样芽孢杆菌等,其中,金黄色葡萄球菌、肠球菌等为临床重要的病原菌
革兰氏阳性菌通常对青霉素类、第一(或第二)代头孢菌素、万古霉素、克林霉素等高度敏感,但是因为抗生素的滥用,MRSA/MRSE、VRSA/VISA、PISP/PRSP、VRE等多重耐药菌已经严重威胁着人类的生命,这些细菌感染时,可以考虑使用万古霉素、共杀素(奎奴普丁/达福普丁)、利奈唑胺、达托霉素、泰利霉素、夫西地酸(建议与耐酶的青霉素类或利福平联用)等。另外,CNS(凝固酶阴性葡萄球菌)等细菌也要引起足够等重视。
革兰氏阴性菌:埃希氏菌属、枸橼酸菌属、假单胞菌属(绿脓杆菌等)、莫拉菌属(卡他莫拉菌等)、奈瑟菌属(淋球菌、脑膜炎双球菌等)、不动杆菌属(鲍曼不动杆菌、罗菲不动杆菌等)、克雷伯菌属(主要是肺炎克雷伯杆菌)、沙门氏菌属、志贺氏菌属(痢疾杆菌等)、黄杆菌属、变形杆菌属、军团菌属、耶尔森菌属、嗜血杆菌属(杜克雷嗜血杆菌、流感嗜血杆菌等)、产气杆菌属、霍乱弧菌、阴沟肠杆菌等。革兰氏阴性菌在院内感染中的细菌感染中占了大约65%,且大多菌株容易对抗菌药物耐药,产生“新德里金属酶”(NDM-1)的绝大多数细菌都是革兰氏阴性菌(主要是大肠杆菌、鲍曼不动杆菌和肺炎克雷伯杆菌)。
革兰氏阴性菌对第三代头孢菌素(头孢他啶、头孢噻肟、头孢曲松等)、氨基糖苷类(庆大霉素、妥布霉素等)、抗假单胞菌属的青霉素类(哌拉西林、替卡西林、羧苄西林等)、多粘菌素等高度敏感,对头霉素类和第二代头孢菌素也较敏感,但是,MDR-AB/PDR-AB、PDR-PA等多重耐药菌给临床用药带来过很大的困难。多粘菌素、碳青霉烯类(亚胺培南、美罗培南等)、替加环素等可以用于多重耐药菌等治疗,但要慎用,否则很可能会到无药可医的地步(绿脓杆菌和鲍曼不动杆菌的一些菌株甚至已经对碳青霉烯类有耐药性)。值得注意的是,头孢哌酮/舒巴坦、哌拉西林/他唑巴坦、替卡西林/克拉维酸、氧头孢烯类(拉氧头孢、氟氧头孢等)对某些多重耐药菌也有特效,比如产ESBLs或AmpC酶的菌株,可以考虑与其他抗菌药物(磷霉素等)联用,另外,多西环素和多粘菌素联用时,几乎对所有对细菌都有协同抗菌作用,也可考虑。
根据细菌的革兰氏染色性质,可以缩小鉴定范围,有利于进一步分离鉴定,以对疾病做出诊断。又由于各种抗生素的抗菌谱不同,革兰氏染色尚可做为选用抗生素的参考。
实验方法步骤革兰氏染色法一般包括初染、媒染、脱色、复染等四个步骤,具体操作方法是:
1)涂片固定。
2)草酸铵结晶紫染1分钟。
3)蒸馏水冲洗。
4)加碘液覆盖涂面染约1分钟。
5)水洗,用吸水纸吸去水分。
6)加95%酒精数滴,并轻轻摇动进行脱色,20秒后水洗,吸去水分。
7)蕃红染色液(稀)染1分钟后,蒸馏水冲洗。干燥,镜检。1
原理通过结晶紫初染和碘液媒染后,在细胞壁内形成了不溶于水的结晶紫与碘的复合物,革兰氏阳性菌由于其细胞壁较厚、肽聚糖网层次较多且交联致密,故遇乙醇或丙酮脱色处理时,因失水反而使网孔缩小,再加上它不含类脂,故乙醇处理不会出现缝隙,因此能把结晶紫与碘复合物牢牢留在壁内,使其仍呈紫色;而革兰氏阴性菌因其细胞壁薄、外膜层类脂含量高、肽聚糖层薄且交联度差,在遇脱色剂后,以类脂为主的外膜迅速溶解,薄而松散的肽聚糖网不能阻挡结晶紫与碘复合物的溶出,因此通过乙醇脱色后仍呈无色,再经沙黄等红色染料复染,就使革兰氏阴性菌呈红色1。
染色的差异主要是阴性与阳性细菌细胞壁的差异所引起的。
①革兰氏阳性细菌的细胞壁
G+细菌细胞壁具有较厚(20-80nm)而致密的肽聚糖层,多达50层,占细胞壁成分的40%~95%,它同细胞膜的外层紧密相连(图2-9)。有的G+细菌细胞壁中含有磷壁酸(teichoic-acid),也称胞壁质(murein),它是甘油和核糖醇的聚合物,磷壁酸通常以糖或氨基酸的酯而存在。由于磷壁酸带负电荷,它在细胞表面能调节阳离子浓度。磷壁酸与细胞生长有关,细胞生长中有自溶素(autolysins)酶类起作用,磷壁酸对自溶素有调节功能,阻止胞壁过度降解和壁溶。
如果细胞壁的肽聚糖层被消溶,G+细胞成为原生质体(protoplasts),细胞壁不复存在,而只存留细胞膜。除链球菌外,大多数G+细菌细胞壁中含极少蛋白质。
②革兰氏阴性细菌的细胞壁 G—细菌细胞壁比G+细菌细胞壁薄(15~20nm)而结构较复杂,分外膜(outer membrane)和肽聚糖层(2~3nm)(图2-10)。在细胞壁和细胞质膜之间有一个明显的空间,称为壁膜间隙(periplasmic space)。
外膜 G—细菌细胞壁外膜的基本成分是脂多糖(lipopolysaccharide,LPS),它同细胞质膜相同之处也是双层类脂,但除磷脂外还含有多糖和蛋白质。
LPS的多糖部分包括核心多糖和O-特异多糖。O-特异多糖由重复分支的碳水化合物分子组成,含有已糖(葡萄糖、半乳糖和鼠李糖)和二脱氧已糖。由于糖的种类不同,使各种G—细胞具有不同特性的LPS。核心多糖(core polysaccharide)的主要组分是酮脱氧辛酸(ketodeoxyoctonate, KDO)。
外膜中还含有几种蛋白,如脂蛋白、通透蛋白。有些蛋白具有通孔作用(porin),调控外界分子进入细胞;有的蛋白分子可以作为噬菌体的受体;许多G—细菌对高等生物有致病性是由LPS的成分决定的,它的毒性组分常称为内毒素(endotoxins)。
肽聚糖层 G—细菌细胞壁的肽聚糖层很薄,在大肠杆菌和其它细菌中仅有单层。肽聚糖层和外膜的内层之间通过脂蛋白连接起来。
壁膜间隙 G—细菌细胞壁的外膜与细胞质膜之间存在明显的壁膜间隙,一层薄的肽聚糖处于其间,肽聚糖层和细胞质膜之间的间隙较宽,肽聚糖层至外膜之间的间隙较窄。大肠杆菌的壁膜间隙宽度为12~15nm,呈胶胨态。其间含有三类蛋白质:水解酶,催化食物的初步降解;结合蛋白,启动物质转运过程;化学受体(chemoreceptors),在趋化性中起作用的蛋白。
染色结果革兰氏阳性菌呈蓝紫色,革兰氏阴性菌呈红色。
临床意义其重要的临床意义在于:1.鉴别细菌 2.选择药物 3.与致病性有关:革兰氏阳性菌能产生外毒素,革兰氏阴性菌能产生内毒素;而内毒素主要是指革兰氏阴性菌胞壁成分中的脂多糖,两者的致病作用不同。
可能误差在实验中经常会出现假阳性和假阴性的结果,假阳性主要是由于脱色不完全,可能是由于涂片过厚,或者是结晶紫染色过度,导致脱色不完全。假阴性可能是因为细胞固定过度,造成细胞壁通透性的改变,而出现假阴性结果;另外,细胞培养时间太长,可能已经有部分细胞发生死亡或者自溶,也导致细胞壁通透性的改变而出现假阴性结果2。
本词条内容贡献者为:
江松敏 - 副教授 - 复旦大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国