历史
亨利·爱丁·圣克莱尔·德维尔和弗里德里希·维勒在1857年首次报道了氮化硅的合成方法。在他们报道的合成方法中,为减少氧气的渗入而把另一个盛有硅的坩埚埋于一个装满碳的坩埚中加热。他们报道了一种他们称之为硅的氮化物的产物,但他们未能弄清它的化学成分。1879年Paul Schuetzenberger通过将硅与衬料(一种可作为坩埚衬里的糊状物,由木炭、煤块或焦炭与粘土混合得到)混合后在高炉中加热得到的产物,并把它报道为成分是Si3N4的化合物。1910年路德维希·魏斯和特奥多尔·恩格尔哈特在纯的氮气下加热硅单质得到了Si3N4。1925年Friederich和Sittig利用碳热还原法在氮气气氛下将二氧化硅和碳加热至1250-1300℃合成氮化硅。
在后来的数十年中直到应用氮化硅的商业用途出现前,氮化硅未受到重视和研究。从1948年至1952年期间,艾奇逊开办在纽约州尼亚加拉大瀑布附近的金刚砂公司为氮化硅的制造和使用注册了几项专利。1958年联合碳化物公司生产的氮化硅被用于制造热电偶管、火箭喷嘴和熔化金属所使用的坩埚。英国对氮化硅的研究工作始于1953年,目的是为了制造燃气涡轮机的高温零件。由此使得键合氮化硅和热压氮化硅得到发展。1971年美国国防部下属的国防高等研究计划署与福特和西屋公司签订一千七百万美元的合同研制两种陶瓷燃气轮机。
虽然氮化硅的特性已经早已广为人知,但在地球自然界中存在的氮化硅(大小约为2×5µm)还是在二十世纪90年代才在陨石中被发现。为纪念质谱研究的先驱阿尔弗雷德·奥托·卡尔·尼尔将自然界中发现的此类氮化硅矿石冠名为“nierite”。不过有证据显示可能在更早之前就在前苏联境内的阿塞拜疆发现过这种存在于陨石中的氮化硅矿石。含有氮化硅矿物的陨石也曾在中国贵州省境内发现过。除存在于地球上的陨石中以外,氮化硅也分布于外层空间的宇宙尘埃中。
晶体结构和特性蓝色圆球是氮原子,灰色圆球是硅原子
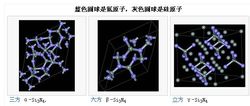
氮化硅(Si3N4)存在有3种结晶结构,分别是α、β和γ三相。α和β两相是Si3N4最常出现的型式,且可以在常压下制备。γ相只有在高压及高温下,才能合成得到,它的硬度可达到35GPa。
合成方法六方 β-Si3N4
可在1300-1400℃的条件下用单质硅和氮气直接进行化合反应得到氮化硅:
3 Si(s) + 2 N2(g) → Si3N4(s)
也可用二亚胺合成
SiCl4(l) + 6 NH3(g) → Si(NH)2(s) + 4 NH4Cl(s) 在0 ℃的条件下
3 Si(NH)2(s) → Si3N4(s) + N2(g) + 3 H2(g) 在1000 ℃的条件下
或用碳热还原反应在1400-1450℃的氮气气氛下合成:
3 SiO2(s) + 6 C(s) + 2 N2(g) → Si3N4(s) + 6 CO(g)
对单质硅的粉末进行渗氮处理的合成方法是在二十世纪50年代随着对氮化硅的重新“发现”而开发出来的。也是第一种用于大量生产氮化硅粉末的方法。但如果使用的硅原料纯度低会使得生产出的氮化硅含有杂质硅酸盐和铁。用二胺分解法合成的氮化硅是无定形态的,需要进一步在1400-1500℃的氮气下做退火处理才能将之转化为晶态粉末,二胺分解法在重要性方面是仅次于渗氮法的商品化生产氮化硅的方法。碳热还原反应是制造氮化硅的最简单途径也是工业上制造氮化硅粉末最符合成本效益的手段。
电子级的氮化硅薄膜是通过化学气相沉积或者等离子体增强化学气相沉积技术制造的:
3 SiH4(g) + 4 NH3(g) → Si3N4(s) + 12 H2(g)
3 SiCl4(g) + 4 NH3(g) → Si3N4(s) + 12 HCl(g)
3 SiCl2H2(g) + 4 NH3(g) → Si3N4(s) + 6 HCl(g) + 6 H2(g)
如果要在半导体基材上沉积氮化硅,有两种方法可供使用:
利用低压化学气相沉积技术在相对较高的温度下利用垂直或水平管式炉进行。
等离子体增强化学气相沉积技术在温度相对较低的真空条件下进行。
氮化硅的晶胞参数与单质硅不同。因此根据沉积方法的不同,生成的氮化硅薄膜会有产生张力或应力。特别是当使用等离子体增强化学气相沉积技术时,能通过调节沉积参数来减少张力。
先利用溶胶凝胶法制备出二氧化硅,然后同时利用碳热还原法和氮化对其中包含特细碳粒子的硅胶进行处理后得到氮化硅纳米线。硅胶中的特细碳粒子是由葡萄糖在1200-1350℃分解产生的。合成过程中涉及的反应可能是:
SiO2(s) + C(s) → SiO(g) + CO(g)
3 SiO(g) + 2 N2(g) + 3 CO(g) → Si3N4(s) + 3 CO2(g) 或
3 SiO(g) + 2 N2(g) + 3 C(s) → Si3N4(s) + 3 CO(g)
特点除氢氟酸外,它不与其他无机酸反应(反应方程式:Si3N4+12HF═3SiF4↑+4NH3↑,抗腐蚀能力强。
应用【氮化硅的应用】
氮化硅用做高级耐火材料,如与sic结合作SI3N4-SIC耐火材料用于高炉炉身等部位;如与BN结合作SI3N4-BN材料,用于水平连铸分离环。SI3N4-BN系水平连铸分离环是一种细结构陶瓷材料,结构均匀,具有高的机械强度。耐热冲击性好,又不会被钢液湿润,符合连铸的工艺要求。见下表
|| ||
更多信息物理性质相对分子质量140.28。灰色、白色或灰白色。属高温难溶化合物,无熔点,抗高温蠕变能力强,不含粘结剂的反应烧结氮化硅负荷软化点在1800℃以上;六方晶系。晶体呈六面体。反应烧结法制得的Si3N4密度为1.8~2.7g/cm3,热压法制得Si3N4密度为3.12~3.22g/cm3。莫氏硬度9~9.5,维氏硬度约为2200,显微硬度为32630MPa。熔点1900℃(加压下)。通常在常压下1900℃左右分解。比热容0.71J/(g·K)。生成热为-751.57kJ/mol。热导率为(2-155)W/(m·K)。线膨胀系数为2.8~3.2×10-6/℃(20~1000℃)。不溶于水。溶于氢氟酸。在空气中开始氧化的温度1300~1400℃。比体积电阻,20℃时为1.4×105 ·m,500℃时为4×108 ·m。弹性模量为28420~46060MPa。耐压强度为490MPa(反应烧结的)。1285℃时与二氮化二钙反应生成二氮硅化钙,600℃时使过渡金属还原,放出氮氧化物。抗弯强度为147MPa。可由硅粉在氮气中加热或卤化硅与氨反应而制得。电阻率在10^15-10^16Ω.cm。1可用作高温陶瓷原料。
生产方法氮化硅陶瓷制品的生产方法有两种,即反应烧结法和热压烧结法。反应烧结法是将硅粉或硅粉与氮化硅粉的混合料按一般陶瓷制品生产方法成型。然后在氮化炉内,在1150~1200℃预氮化,获得一定强度后,可在机床上进行机械加工,接着在1350~1450℃进一步氮化18~36h,直到全部变为氮化硅为止。这样制得的产品尺寸精确,体积稳定。热压烧结法则是将氮化硅粉与少量添加剂(如MgO、Al2O3、MgF2、AlF3或Fe2O3等),在19.6MPa以上的压力和1600~1700℃条件下压热成型烧结。通常热压烧结法制得的产品比反应烧结制得的产品密度高,性能好。附表1中列出了这两种方法生产的氮化硅陶瓷的性能。
其他应用氮化硅陶瓷材料具有热稳定性高、抗氧化能力强以及产品尺寸精确度高等优良性能。由于氮化硅是键强高的共价化合物,并在空气中能形成氧化物保护膜,所以还具有良好的化学稳定性,1200℃以下不被氧化,1200~1600℃生成保护膜可防止进一步氧化,并且不被铝、铅、锡、银、黄铜、镍等很多种熔融金属或合金所浸润或腐蚀,但能被镁、镍铬合金、不锈钢等熔液所腐蚀。
氮化硅陶瓷材料可用于高温工程的部件,冶金工业等方面的高级耐火材料,化工工业中抗腐蚀部件和密封部件,机械加工工业的刀具和刃具等。
由于氮化硅与碳化硅、氧化铝、二氧化钍、氮化硼等能形成很强的结合,所以可用作结合材料,以不同配比进行改性。
此外,氮化硅还能应用到太阳能电池中。用PECVD法镀氮化硅膜后,不但能作为减反射膜可减小入射光的反射,而且,在氮化硅薄膜的沉积过程中,反应产物氢原子进入氮化硅薄膜以及硅片内,起到了钝化缺陷的作用。这里的氮化硅氮硅原子数目比并不是严格的4:3,而是根据工艺条件的不同而在一定范围内波动,不同的原子比例对应的薄膜的物理性质有所不同。
用于超高温燃气透平,飞机引擎,电炉等。2
结构正八面体的两个顶是Si,四个N就是八面体的中间平面的4个点,然后以这四个N产生的平面的中心,就是最后第三个Si了。一定要确认每个Si都连着四个N,每个N都连着3个硅,N-N之间没有连接
材料性能氮化硅的强度很高,尤其是热压氮化硅,是世界上最坚硬的物质之一。它极耐高温,强度一直可以维持到1200℃的高温而不下降,受热后不会熔成融体,一直到1900℃才会分解,并有惊人的耐化学腐蚀性能,能耐几乎所有的无机酸和30%以下的烧碱溶液,也能耐很多有机酸的腐蚀;同时又是一种高性能电绝缘材料。
氮化硅 - 性质 化学式Si3N4。白色粉状晶体;熔点1900℃,密度3.44克/厘米(20℃);有两种变体:α型为六方密堆积结构;β型为似晶石结构。氮化硅有杂质或过量硅时呈灰色。
氮化硅与水几乎不发生作用;在浓强酸溶液中缓慢水解生成铵盐和二氧化硅;易溶于氢氟酸,与稀酸不起作用。浓强碱溶液能缓慢腐蚀氮化硅,熔融的强碱能很快使氮化硅转变为硅酸盐和氨。氮化硅在 600℃以上能使过渡金属(见过渡元素)氧化物、氧化铅、氧化锌和二氧化锡等还原,并放出氧化氮和二氧化氮。1285℃ 时氮化硅与二氮化三钙Ca3N2发生以下反应:
Ca3N2+Si3N4─→3CaSiN23
氮化硅的制法有以下几种: 在1300~1400℃时将粉状硅与氮气反应; 在1500℃时将纯硅与氨作用;
在含少量氢气的氮气中灼烧二氧化硅和碳的混合物;将SiCl4的氨解产物Si(NH2)4完全热分解。氮化硅可用作催化剂载体、耐高温材料、涂层和磨料等。
氮化硅陶瓷具有高强度、耐高温的特点,在陶瓷材料中其综合力学性能最好,耐热震性能、抗氧化性能、耐磨损性能、耐蚀性能好,是热机部件用陶瓷的第一候选材料。在机械工业,氮化硅陶瓷用作轴承滚珠、滚柱、滚球座圈、工模具、新型陶瓷刀具、泵柱塞、心轴 密封材料等。
在化学工业,氮化硅陶瓷用作耐磨、耐蚀部件。如球阀、泵体、燃烧汽化器、过滤器等。
在治金工业,由于氮化硅陶瓷耐高温,摩擦系数小,具有自润滑性。对多数金属、合金溶液稳定,因此,可制作金属材料加工的工模具,如拨菅芯棒、挤压、拨丝模具,轧辊、传送辊、发热体夹具、热偶套营、金属热处理支承件、坩埚,铝液导营、铝包内衬等。
氮化硅陶资材料在电子、军事和核工业方面也有广泛应用。
1、氮化硅陶瓷粉末的物理化性能及产品的技术指标
氮化硅陶瓷是一种白灰色粉末,分子式为:SI3N4 ;
分子重量:140.3 , 密度3.2g/cm³
其化学成分:N>38-39;0




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国