化学性质
还原性**:**隔绝空气加热会歧化为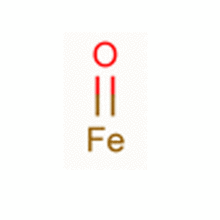 铁单质和四氧化三铁,在空气中加热会被氧化为氧化铁或四氧化三铁。
铁单质和四氧化三铁,在空气中加热会被氧化为氧化铁或四氧化三铁。
氧化性**:**(高温下)被CO、H2、Al、C、Si等还原。
**铁****的其它氧化物:**氧化亚铁(FeO)、氧化铁(Fe2O3)、四氧化三铁(Fe3O4).
**结构:**氧化亚铁属于立方晶系(类似于氯化钠晶体结构),每个铁原子周围连接着6个氧原子形成八面体型配位,每个氧原子周围也以同样的情况连接着6个铁原子。出现非整比化合物的原因在于,由于二价铁很容易被氧化为三价铁,导致FeO中少量二价铁被替换为三价铁,占据晶格中的四面体空隙。
在低于200K时,氧化亚铁的晶体结构会发生微小变化,变为菱方,并且具有反铁磁性。
FeO中,铁显+2价
物理性质**热导率:**3.2 W/m·K。
**比热容:**725 J/kg·K。
**稳定性:**不稳定,在空气中加热时迅速被氧化成四氧化三铁,溶于盐酸、稀硫酸生成亚铁盐。
**溶解性:**不溶于水,不与水反应。
制备方法1. 在隔绝空气条件下加热草酸亚铁制得:
FeC2O4═△═FeO+CO↑+CO2 ↑
2. 炼钢时,过量的生铁水与O2反应生成一些铁氧化物
3.在实验室条件下,可根据铁氧化物还原叉子曲线控制氧分压和温度,以Fe2O3和Fe为原料获得高纯FeO:
Fe2O3+Fe=3FeO
相关反应FeO在低于575℃的条件下具有热不稳定性,可以分解生成铁和Fe3O4:(注明前面发这个
反应生成只有→ 没有═ 而且如果有催化剂一些催化剂写在→上面反应条件写在→下面 反应条件都没有)
4FeO ═△═Fe+Fe3O4
FeO可与一些元素单质反应,而被还原为铁单质:
Si+2FeO ═SiO2+2Fe
Mn+FeO ═MnO+Fe
2 P+5FeO═P2O5+5Fe
FeO可溶于盐酸或稀硫酸,并分别生成氯化亚铁和硫酸亚铁。
FeO+2 HCl ═ FeCl2+H2O
FeO+H2SO4═FeSO4+H2O
草酸亚铁加热制取,草酸亚铁受热分解,生成氧化亚铁、一氧化碳和二氧化碳。
FeC2O4 ═△═FeO+CO↑+CO2↑
这里制得的氧化亚铁是能自燃的黑色粉末,它在低于848K时不稳定。1
FeO+CO=高温=Fe+CO2
验证方法方法1:1.先用过量稀硫酸酸溶解固体,使其转化成溶液
2.再向上述溶液中滴加KSCN溶液无血红色,说明无铁离子
3.再向2步所得溶液中滴加高锰酸钾溶液,如出现血红色,说明出现了铁离子,说明第1步中所得溶液中有亚铁离子,从而证明有 FeO存在
方法2:试剂:用稀硫酸和KMnO4溶液
过程:稀硫酸浸取待测物,如溶液使得KMnO4褪色,说明有FeO
主要用途可以被用作色素,在化妆品和刺青墨水中都有应用.氧化亚铁也应用于瓷器制作中使釉呈绿色。但是这个物质不稳定,很容易被氧化成四氧化三铁。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国