物理性质
氮化镁(Mg3N2) 是由氮和镁所组成的无机化合物,立方晶系。在室温纯净的氮化镁下为灰白色的粉末,但含有一部分氧化镁杂质的氮化镁是灰白色的。1能溶于酸,微溶于乙醇和乙醚。
是由氮和镁所组成的无机化合物,立方晶系。在室温纯净的氮化镁下为灰白色的粉末,但含有一部分氧化镁杂质的氮化镁是灰白色的。1能溶于酸,微溶于乙醇和乙醚。
化学性质氮化镁和许多金属氮化物一样,会和水反应产生氨。
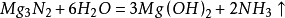
与酸或含水的非金属氧化物反应,生成铵盐和镁盐。
主要用途1、制备高硬度、高热导、抗腐蚀、抗磨损和耐高温的其它元素的氮化物时作为催化剂。第一次成功合成立方氮化硼时,使用的催化剂就是氮化镁;
2、用于高强度钢冶炼的添加剂。氮化镁(Mg3N2)替代建筑钢材冶炼中的脱硫镁,有利的提高钢材的密度、强度、拉力及承受力。另外使用氮化镁(Mg3N2)脱硫,可以适量减少其他添加剂,从而有助于降低建筑钢材的生产成本;
3、制备特殊的陶瓷材料;
4、制造特殊的合金的发泡剂;
5、用于制造特种玻璃;
6、催化聚合物交连;
7、核废料的回收;
8、用于人造金刚石合成的触媒及立方氮化硼的触媒材料。2
制备方法要制备氮化镁,可将镁带在氮气中燃烧而成。其反应方程式为:
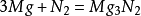
以上反应如果氮气不纯则易生成含氧化镁的产品。在干燥的NH3气体中反应的方法就更好些。
将镁屑置于瓷舟或烧结氧化镁舟中,舟装在瓷管中,瓷管一端连接T形管,T形管一端可通入干燥的氨气,另一端可通入氮气。瓷管末端连接U形管,管中装有干燥剂,一半是小片状的CaO,另一半是小片状的KOH。反应管排出的气体被吸收装置吸收,吸收装置是两个盛有稀硫酸的锥形瓶。为防止发生倒吸,第一个吸收瓶的导管不要插到稀硫酸液面之下。
向瓷管中通入干燥的NH3和N2,至第二个吸收瓶不再冒出气泡时,说明瓷管内空气已经赶净。升温至800~850℃,加热镁粉4h,镁粉变得炽热,标志着反应的开始,与此同时必有H2产生。反应过程中NH3的气压要大于外界大气压,以免倒吸。反应结束,关闭NH3,保持原来的温度继续通N2 1.5h,以除去被吸附在Mg3N2上的NH3·Mg3N2极易潮解,必须保存在干燥的容器中。2
若将镁带在空气中燃烧,除了会产生氧化镁之外,也会产生一些氮化镁。
存储运输因为氮化镁容易与水(H2O)化合分解,因此需要真空密封保存,防水、防潮。
对水体是稍微有害,不要将未稀释或大量产品接触地下水,水道或污水系统,未经政府许可勿将材料排入周围环境。
安全信息危险运输编码:UN 2813 4.3/PG 1
危险品标志:刺激
安全标识:S26S36
危险标识:R36/37/383
计算化学数据1、 氢键供体数量:0
2、 氢键受体数量:2
3、 可旋转化学键数量:0
4、 拓扑分子极性表面积(TPSA):2
5、 重原子数量:5
6、 表面电荷:0
7、 复杂度:8.9
8、 同位素原子数量:0
9、 确定原子立构中心数量: 0
10、 不确定原子立构中心数量:0
11、 确定化学键立构中心数量:0
12、 不确定化学键立构中心数量:0
13、 共价键单元数量:2 2




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国