电离度的定义和计算
电离度(α)= (已电离弱电解质分子数/原弱电解质分子数)*100%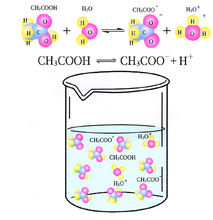
对于一元弱酸,当c∕Ka≥500时,可以推导出一元弱酸电离度与氢离子浓度的近似公式:
[H+] =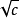 ·Ka
·Ka
α=[H+]/c=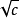 ·Ka/c=
·Ka/c=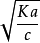
对于一元弱碱,当c∕Kь≥500时,可以推导出一元弱碱电离度与氢氧根离子浓度的近似公式:
[OHˉ]=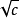 ·Kь
·Kь
α=[OHˉ] =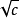 ·Kь/c =
·Kь/c =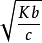
由上述公式可以看出:
当温度与浓度一定时,对于不同的弱电解质,Ka或Kь越大,则α越大,溶液酸性(对于一元弱酸)或碱性(对于一元弱碱)越强。
当温度一定时,对于同一弱电解质来说,浓度越小,则α越大,但溶液酸性(对于一元弱酸)或碱性(对于一元弱碱)越弱。
多元弱酸、弱碱的电离是分步进行的,每步电离都存在相应的电离平衡。实验和理论计算证明,它们的二步电离度远远小于一步电离度,三步电离度又远远小于二步电离度。所以,多元弱酸溶液的氢离子浓度,多元弱碱溶液的氢氧根离子浓度,均可以近似以一步电离的离子浓度代替。
因此,在表示弱电解质的电离度时,必须指明溶液的浓度和温度。
气体电离度可用如下公式表示:α=n/N;
n:带电离子数目;
N:气体质点总数目。1
影响电离度的因素引起电离的原因很多。例如,气体粒子受电子或离子的撞击或受电磁波(光、X 射线等)的辐照,固体表面受电子或离子轰击,固体受到高热等,都有可能产生电离现象。
内因:电解质的本性。 外因:温度和溶液的浓度等。
外因:温度和溶液的浓度等。
浓度的影响当溶液浓度下降时,有利于弱电解质分子变为自由水合离子,电离度增大;当溶液浓度升高时,有利于自由水合离子变为弱电解质分子,电离度减少。因浓度越稀,离子互相碰撞而结合成分子的机会越少,电离度就越大。
温度的影响因为电离过程是吸热的,因此温度升高离子化倾向加强,又因大多数电解质电离时没有显著的热量变化,这就导致温度对电离度虽有影响,但影响并不大的必然结果。一般情况下,温度对电离度影响不大,但水的离解过程显著吸热,所以温度升高可以增大水的电离度。
因此,用电离度比较几种电解质的相对强弱时,就当注意所给条件,即浓度和温度,如不注明温度通常指25℃。在相同温度和浓度时,电离度的大小可以表示弱电解质的相对强弱。1
电离常数与电离度电离常数又叫电离平衡常数,用Ki表示。如醋酸,碳酸和硼酸。其定义为,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数。一种弱电解质的电离平衡常数只与温度有关,而与该弱电解质的浓度无关。因为弱电解质通常为弱酸或弱碱,所以在化学上,可以用Ka、Kb分别表示弱酸和弱碱的电离平衡常数。
用HA表示弱酸,则其电离方程式为HA——H+A,则电离常数Ka=[H]*[A]/HA
电离常数K与电离度α的关系可近似的表示为K=cα2其中c为弱电解质溶液的浓度。1
概念辨析第一,区分好电离度和离子浓度。弱酸、弱碱溶液在稀释过程中,溶液浓度下降,电离度肯定增大,离子浓度不一定增大,离子浓度由溶液浓度与电离度的乘积决定。
第二,区分好溶液浓度与离子浓度。在25℃时,1mol乙酸溶液的电离度为1%,离子浓度是0.01mol/L,溶液浓度是离子浓度的100倍。
乙酸溶液与Mg粉发生置换反应,研究反应速率要依据离子浓度,研究产物的质量则需依据溶液的浓度进行定量的计算,这是由于化学反应发生时,乙酸电离平衡不断向正方向移动的缘故。1




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国