化学方程式,也称为化学反应方程式,是用化学式表示化学反应的式子。化学方程式反映的是客观事实。用化学式(有机化学中有机物一般用结构简式)来表示物质化学反应的式子,叫做化学方程式。1
化学方程式不仅表明了反应物、生成物和反应条件。同时,化学计量数代表了各反应物、生成物物质的量关系,通过相对分子质量或相对原子质量还可以表示各物质之间的质量关系,即各物质之间的质量比。对于气体反应物、生成物,还可以直接通过化学计量数得出体积比。
书写要点书写步骤以 受热分解的化学方程式为例:
受热分解的化学方程式为例:
第一步:写出反应物和生成物的化学式。
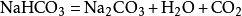
第二步:配平化学式。
第三步:注明反应条件和物态等。
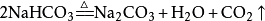
第四步:检查化学方程式是否正确。2
反应条件1.热化学方程式写反应条件。一般的在等号上方标记Δ。配平系数大多不可以是可以是分数(相互之间可以约分除外)。
2.常温常压下可以进行的反应,不必写条件;但是题目中的实验若有特定的条件,一律标注该特定条件(如加热)。
3.反应单一条件时,条件一律写上面;有两个或更多条件的,上面写不下的写在下面;既有催化剂又有其它反应条件时,一律把催化剂写在上面。
4.是可逆反应的一律用双向箭头表示。2
箭头与等号在专业领域的文献中,不论无机、有机反应方程式中均使用箭头号“→ ”来连接反应物和生成物。国外化学教科书、上海市中学化学二期课改教材(上海科学技术出版社2006年7月,姚子鹏主编)、2011-2012苏教版化学书、上海高考的化学卷、理综卷中也采用了箭头号。但在多数省市的中学教学中,仍建议按照教材在书写无机化学反应方程式时使用等号,以更好地表示反应中的“生成”与“质量守恒”含义。2
2013年中学阶段无机反应方程式一律用等号连接反应物和生成物,有机反应一律用箭头来连接反应物和生成物,是可逆反应的一律用可逆符号表示。2
气体符号与沉淀符号1. 气体符号“↑”和沉淀符号“↓”是化学反应中生成物的状态符号。只有生成物才能使用“↑”或“↓”符号,使用时写在相应化学式的右边。
2. 当生成物在反应条件是气态的,才用“↑”号,如:
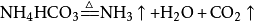
但还必须同时注意两点:
(1)若反应物中有一种或几种气态物质,则生成的气态物质不再用“↑”号,如:
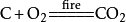
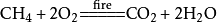
(2)不论反应物状态如何,只要产物只有一种物质,且是气体时也不用“↑”。
3. 在溶液中进行的化学反应,有难溶物质或不溶物质生成时,用“↓”号表示。如:

4. 若反应不是在溶液中进行的,就不存在沉淀析出现象,不能用“↓”号。如:
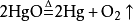
5. 对于金属与盐溶液之间的置换反应,生成的金属单质,由于覆盖在金属的表面,没有沉淀析出,不应使用“↓”号,如:
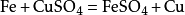
6. 在复分解反应中,若生成物是微溶物时,应把它视为“沉淀”,标上“↓”。如:
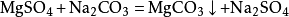
7. 必须以客观事实为依据,即使是同一个化学反应,也必须要看具体情况。如硫化氢与二氧化硫气体混合反应生成硫,不用沉淀符号,即:
 当把二氧化硫通入到氢硫酸时,溶液中出现了黄色的浑浊现象,生成的单质硫应标上“↓”,即
当把二氧化硫通入到氢硫酸时,溶液中出现了黄色的浑浊现象,生成的单质硫应标上“↓”,即
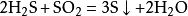
又如向氯化银悬浊液中滴加硫化钠溶液,白色沉淀变成黑色,发生了沉淀的转化,生成的硫化银应标上“↓”,即:

物质状态热化学方程式
加热化学方程式需要标出每一个反应物、生成物的状态,可分g (气体)、l (液体)、s (固体)、aq (溶液)四大类。字母外需要打括号,例如H2O (l)、Na2CO3(aq)、CaCO3(s)。
普通方程式则不用g、l、s、aq的标记。生成物方面,当反应物中不含气体时,气体生成物要用“↑”标记;只有在溶液中,反应物中不含固体时,难溶或固体生成物一律用“↓”标记。如电解池反应的化学方程式:

由于生成Cu吸附在电极上,故不写“↓”。2
水蒸气
水蒸气一般打箭头,但偶有例外(碳酸氢铵受热分解)。
反应物状态的不同
反应物若以特殊状态参加反应,例如浓硫酸、熔融氧化铝,过量,少量,一律在相应的反应物后打括号注明状态
反应物的浓度不同,产物不同
如:铜与浓硝酸反应的化学方程式:
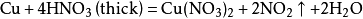
铜与稀硝酸反应的化学方程式:

反应物的量不同,产物不同
如:镁与过量二氧化碳反应的化学方程式:

镁与少量二氧化碳反应的化学方程式:

反应物的物态不同,产物不同
如:电解氯化钠溶液的化学方程式:

电解熔融氯化钠的化学方程式:
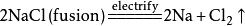
技巧要正确书写物质的化学式,一是要熟练记忆元素符号,二是书写化合物的化学式时,要熟练记忆常见元素和原子团的化合价,三是书写化合物的化学式要符合各元素正负化合价的代数和为零的原则,四是掌握书写化学式的一般方法。总起来说,这就是书写化学式的要领。3
化学式的一般写法是:
(1)单质的化学式
除H2、O2、N2、F2、Cl2、Br2和I2七种单质为双原子分子,O3为三原子分子,P4为四原子分子外,其余单质(稀有气体、金属单质和非金属固态单质等)都是以元素符号表示其化学式。
(2)化合物的化学式
书写时一般规律是先读后写,后读先写;排好顺序,写好角号。一般将显正价的元素或原子团写在左边,显负价的元素或原子团写在右边。其书写步骤是:定位、标价、交叉约简和检验四步。
例如:写出氧化铝、磷酸、氢氧化铜和硫酸铁的化学式。
①定位:确定元素或原子团的顺序。
②标价:正确地在各元素或原子团的上方标出化合价。
③交叉约简:将化合价的绝对值交叉写在对方元素或原子团的右下方,能约简的要约为最简约数。原子或原子团的个数为1时,通常1省去不写。原子团在2个或2个以上时,应加上括号。
④检验:当正价总数与负价总数之和为零时,化学式正确。
书写的技巧1.书写化学方程式的步骤
以书写碳在高温时跟氧化铁反应的化学方程式为例,归纳步骤如下:
①根据反应的事实(该反应生成铁和二氧化碳气体),在式子的左边写出反应物的化学式,在式子的右边写出生成物的化学式。反应物或生成物不止一种,就分别用加号把它们连接起来(反应物之间的“+”号表示“……跟……反应”,生成物之间的“+”号表示“……跟……”),并在式子左、右之间划一条短线段。在这一步里,一定要注意把各种物质的化学式写正确,否则,写出的式子无意义!

②根据质量守恒定律,用配系数的方法,使左、右两边同一元素原子的个数相等(即配平),然后将短线段改为等号(等号表示“生成了……”)。应当注意,配平时只能选择适当的系数,不能改变化学式。

③在等号或箭号上、下方注明反应条件,如点燃、电解、高温、加热(用“△”号表示)、催化剂等,同时,标明生成物中的气体或沉淀产物的状态。生成物是气体的在其化学式的右边加上“↑”号(反应物中如有气体,则气态生成物不再标“↑”符号);产物是沉淀的加“↓”号。
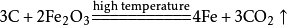
概而言之,在书写化学方程式时,必须要符合化学反应的客观规律,不能凭空臆造。书写程序一般是:写好化学式—系数要配平—中间联等号—条件要注清—生成气体或沉淀,要用箭号来标明。
要写好化学方程式,还要熟练掌握和运用酸、碱、盐的溶解性表,金属活动性顺序和常见元素、原子团的化合价,以及书写物质化学式的技能。
2.化学方程式书写中常见错误简析
一是乱套“公式”。一些同学书写化学方程式时,虽然注意了不能凭空臆造化学式,但又没有掌握典型记忆与类型推导相结合的方法,加之缺乏化学基础知识,因而把记住的某个熟悉的化学方程式当作为一般公式去套用,犯了乱套“公式”的错误。
二是乱写逆反应。产生此类错误的原因是,初中学生把化学方程式与数理方程式混为一谈,随意把化学方程式倒过来写。我们知道,数理方程式可以移项,或将等号左右两端反过来写;而化学方程式与数理方程式是绝然不同的两种概念。虽然有些化学反应是可逆的,但多数化学反应并非如此。至于有些反应,在相同或不相同的条件下,能够向相反方向进行,也不一定是可逆反应,而是意义完全相反的反应类型。
三是乱标生成物的状态和反应条件。
四是乱写化学式。4例如:
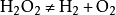



计算1. 根据化学方程式的计算
化学方程式不仅表示什么物质参加反应和反应后生成什么物质,而且还表示反应物和生成物各物质间的质量比。根据化学方程式的计算就是依据反应物和生成物之间的质量比进行的。因此,已知反应物的质量可以算出生成物的质量;已知生成物的质量可以算出反应物的质量;已知一种参加反应的反应物的质量可以算出另一种参加反应的反应物的质量;已知一种生成物的质量可以算出另一种生成物的质量。
化学计算题是从“量”的方面来反映物质及其变化规律的。化学计算包括化学和数学两个因素,其中化学知识是数学计算的基础,数学又是化学计算的工具。根据化学方程式的计算,必须对有关的化学知识有清晰的理解,熟练掌握有关反应的化学方程式。如果化学方程式中的化学式写错了,或者没有配平,化学计算必然会得出错误结果。
2. 根据化学方程式计算的步骤
(1)根据题意设未知量。
(2)根据题意写出正确的化学方程式。
(3)写出有关物质的相对分子质量或相对分子质量和以及已知量和未知量。写在化学方程式的相对应的化学式的下面。
(4)列比例式,求解。
(5)简明的答题。
3. 根据化学方程式计算的注意事项
(1)解题格式必须规范。
(2)根据化学方程式计算是以纯净物的质量进行计算,对于不纯的反应物或不纯的生成物必须折算成纯净物的质量,再进行计算。
(3)必须正确使用单位。
4. 根据化学方程式计算时,常见的错误:
(1)不认真审题,答非所问。
(2)元素符号或化学式写错。
(3)化学方程式没有配平。
(4)相对分子质量计算错误。
(5)单位使用错误。
(6)把不纯物质当成纯净物进行计算。
配平方法最小公倍数法A、找出原子个数较多,且在反应式两边各出现一次的原子,求它的最小公倍数。
B、推出各分子的系数。
例如:
第一步:CuSO4+NaOH—Cu(OH)2+Na2SO4
第二步:CuSO4+2NaOH—Cu(OH)2+Na2SO4(配平)
第三步:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4(注明生成物物态)
观察法从化学式较复杂的一种生成物推算有关各反应物化学式的化学计量数和该生成物的化学计量数;根据求得的化学式的化学计量数,再找出其他化学式的化学计量数,直至配平。
例如: 第一步 H2O(g)+Fe---Fe3O4+H2
第二步 4H2O(g)+3Fe---Fe3O4+H2
第三步 4H2O(g)+3Fe=Fe3O4+4H2(反应条件:加热)
奇偶配平法看哪种元素在反应化学方程式左右两边出现次数最多;从该元素个数为奇数的化学式入手,将其配成偶数(即化学计量数为2);由它求得的化学计量数配平其他化学式的化学计量数,使两边原子个数相等。
例:配平
H2O(g)+Fe---Fe3O4+H2
第一步:配平氧原子
4H2O(g)+Fe---Fe3O4+H2
第二步:配平氢原子、铁原子
4H2O(g)+3Fe---Fe3O4+4H2
第三步:配平后的化学方程式:
4H2O(g)+3Fe=Fe3O4+4H2(反应条件:加热)
得氧失氧法对于氧化还原反应,先观察得出氧化剂失氧的数目,再观察得出还原剂得氧的数目,然后配平
比如:3CO+Fe2O3=2Fe+3CO2
氧化剂氧化铁反应前后失掉三个氧,还原剂一氧化碳反应前后得到一个氧,所以需要三个一氧化碳才能夺去氧化铁中的氧,一氧化碳、二氧化碳配3,铁配2
初中常见反应氧气(1)单质与氧气的反应:(化合反应)
1. 镁在氧气中燃烧: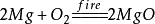
2.铁在氧气中燃烧: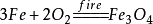
3. 铜在氧气中受热: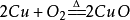
4. 氢气在氧气中燃烧: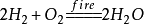
5.红磷在氧气中燃烧(研究空气组成的实验):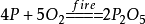
6.硫在氧气中燃烧:
7. 碳在氧气中充分燃烧:
8. 碳在氧气中不充分燃烧:
(2)氧气与化合物的反应:
10.一氧化碳在氧气中燃烧:
11.甲烷在氧气中燃烧:
12.酒精在氧气中燃烧:
(3)氧气的来源:
13.拉瓦锡研究空气的成分实验
14.加热高锰酸钾: (实验室制氧气原理1)
(实验室制氧气原理1)
15.加热氯酸钾和二氧化锰混合物: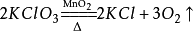 (实验室制氧气原理2)
(实验室制氧气原理2)
16.过氧化氢在二氧化锰作催化剂条件下分解反应: (实验室制氧气原理3)
(实验室制氧气原理3)
植物的光合作用:6CO2+6H2O ==光/叶绿素== 6O2+C6H12O6
水17.水在直流电的作用下分解(研究水的组成实验):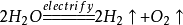
18.生石灰溶于水: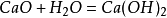
碳和碳氧化物(1)碳的化学性质
19. 碳在氧气中充分燃烧:
20.木炭还原氧化铜: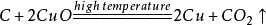
21. 焦炭还原氧化铁:
(2)煤炉中发生的三个反应:(几个化合反应)
22.煤炉的底层:
23.煤炉的中层: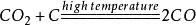
24.煤炉的上部蓝色火焰的产生:
(3)二氧化碳的制法与性质:
25.大理石与稀盐酸反应(实验室制二氧化碳):
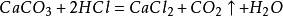
26.碳酸不稳定而分解:
27.二氧化碳可溶于水: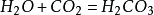
28.高温煅烧石灰石(工业制二氧化碳):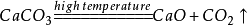
29.石灰水与二氧化碳反应(鉴别二氧化碳):
30.石灰水与二氧化硫反应(所以反应中有硫元素的参与,澄清石灰水就不能鉴别二氧化碳)
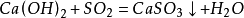
(4)一氧化碳的性质:
31.一氧化碳还原氧化铜: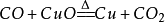
32.一氧化碳的可燃性:
其它反应:
33.碳酸钠与稀盐酸反应(化学反应式灭火器的原理):
金属(1)金属与氧气反应:
34. 镁在空气中燃烧:
35. 铁在纯氧中燃烧: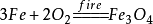
36. 铜在空气中受热:
37. 铝在空气中形成氧化铝薄膜:
(2)金属单质 + 酸 →盐 + 氢气 (置换反应)
38. 锌和稀硫酸(实验室制氢气)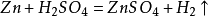
39. 铁和稀硫酸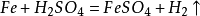
40. 镁和稀硫酸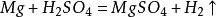
41. 铝和稀硫酸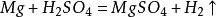
(3)金属单质 + 盐(溶液) →新金属 + 新盐
42. 铁和硫酸铜溶液反应: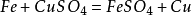
43. 锌和硫酸铜溶液反应:
44. 铜和硝酸汞溶液反应:
45. 铜和硝酸银反应:
46.铝和硫酸铜溶液反应: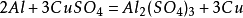
(4)铁的冶炼原理:
47.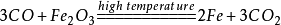
高中常见反应
|| ||
记忆方法掌握化学方程式的书写要领
左写反应物,右边写生成,写对化学式,系数来配平,中间连等号,条件要注清,生成沉淀气,箭头来标明。
归类记忆
根据知识系列或反应类型或物质类别记忆,使零散的知识通过归纳成为有规律可循、以重点物质为中心的知识网络。
联系实验现象记忆
化学方程式枯燥难记,如何使化学用语的学习有声有色、兴趣盎然,可联系实验现象记忆。如硫在氧气中燃烧,记忆联想:燃硫入氧,燃烧变旺,火焰蓝紫,美丽漂亮,产生气体,可真够“呛”。磷在氧气中燃烧,记忆联想:红磷燃烧,可真热闹,浓烟滚滚,亮似“灯泡”。
本词条内容贡献者为:
王洪亮 - 副教授 - 中国农业大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国