ALP是指碱性磷酸酶,英文全称为alkaline phosphatase ,是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,这类底物包括核酸、蛋白、生物碱等。
简介碱性磷酸酶广泛分布于人体各脏器器官中,其中以肝脏为最多,其次为肾脏、骨骼、肠和胎盘等组织。ALP测定值,是反映肝外胆道梗阻、肝内占位性病变和佝偻病的重要指标。血清中的ALP主要来自肝脏和骨骼。生长期儿童血清内的大多数ALP来自成骨细胞和生长中的软骨细胞,少量来自肝脏。临床上测定ALP主要用于骨骼、肝胆系统的疾病诊断和鉴别诊断,尤其是黄疸的鉴别诊断。对于不明原因的高ALP血清水平,可测定同工酶以协助明确其器官来源。1
ALP/AKP通指碱性磷酸酶,碱性磷酸酶属于同源二聚体蛋白,分子量为56KDa。每个单体由449个氨基酸组成,完整的ALP分子呈现典型的α/β的拓扑结构,同时每个单体均具有一个活性中心,活性中心区域由Asp101-Ser102-Ala103三连体、Arg166、水分子、三个金属离子及其配体氨基酸组成。ALP被phoA 基因编码,与很多分泌蛋白一样,在细胞质内合成氨基末端带有信号肽的单体前体,信号肽引导前体跨内膜运输后被切除,同源二聚体形成。 碱性磷酸酶是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,这类底物包括核酸、蛋白、生物碱等。而该脱去磷酸基团的过程被称为去磷酸化或脱磷酸化。碱性磷酸酶是磷酸酶的一种,磷酸酶的作用与激酶的作用正相反,激酶是磷酸化酶,可以利用能量分子,如ATP,将磷酸基团加到对应底物分子上。碱性磷酸酶在碱性环境有最大活力,对来源于细菌中的ALP来说,其最适pH是8.0,而对来源于牛的ALP则是8.5。1
碱性磷酸酶是一种能够将对应底物去磷酸化的酶,即通过水解磷酸单酯将底物分子上的磷酸基团除去,并生成磷酸根离子和自由的羟基,这类底物包括核酸、蛋白、生物碱等。而该脱去磷酸基团的过程被称为去磷酸化或脱磷酸化。碱性磷酸酶是磷酸酶的一种,磷酸酶的作用与激酶的作用正相反,激酶是磷酸化酶,可以利用能量分子,如ATP,将磷酸基团加到对应底物分子上。碱性磷酸酶在碱性环境有最大活力,对来源于细菌中的ALP来说,其最适pH是8.0,而对来源于牛的ALP则是8.5。1
病理过度疲劳和饮酒都会导致ALP偏高,碱性磷酸酶(ALP)是指一组底物特异性很低,在碱性环境中能水解很多磷酸单酯化合物的酶,需要镁和锰离子为激活剂。认为ALP真正作用是将底物中磷酸基团转移到另一个含羟基基团化合物上,磷酸乙醇胺有可能是ALP在体内作用的底物。1
生理作用ALP确切的生理作用仍不十分清楚,一般认为骨中ALP和骨的钙化作用密切相关 ,成骨细胞中的ALP作用产生磷酸,与钙生成磷酸钙沉积于骨中。ALP还广泛存在于肝细胞血窦侧和胆小管膜上、肾近侧曲管刷状缘和小肠粘膜的微绒毛,据此推测它可能还与物质的吸收和运转过程有关。 各器官的ALP在理化性质都有些差异,临床上长期认为存在着肝、骨、小肠和胎盘等ALP,在病理时还可能出现高分子ALP,以及一些和肿瘤有关的变异ALP,如Regan、NagaoALP等。深一步研究发现这些ALP主要受3个基因位点控制,相应生成3大类ALP,即小肠、胎盘和组织非特异ALP,后者包括临床上所谓的骨、肝、肾等组织器官,它们的氨基酸结构类似,抗原性无差别,这些酶电泳速率和对不同抑制剂反应差异来自ALP中所含糖基的不同。碱性磷酸酶广泛分布于人体的骨、肝、肠、胎盘等组织中。主要用于阻塞性黄疸、原发性肝癌、继发性肝癌、胆汁淤积性肝炎的检查。患这些疾病时,肝细胞过度制造ALP,经淋巴道和肝窦进入血液,同时由于肝内胆道胆汁排泄障碍,反流入血而引起血清碱性磷酸酶明显升高。但由于骨组织中此酶亦很活跃。因此,孕妇、骨折愈合期、骨软化症。佝偻病、骨细胞癌、骨质疏松、肝脓肿、肝结核、肝硬变、白血病、甲状腺机能亢进时,血清碱性磷酸酶亦可升高,应加以鉴别。碱性磷酸酶的升高,只说明身体内部的一些现象。并不能确认就是某种疾病。2
,成骨细胞中的ALP作用产生磷酸,与钙生成磷酸钙沉积于骨中。ALP还广泛存在于肝细胞血窦侧和胆小管膜上、肾近侧曲管刷状缘和小肠粘膜的微绒毛,据此推测它可能还与物质的吸收和运转过程有关。 各器官的ALP在理化性质都有些差异,临床上长期认为存在着肝、骨、小肠和胎盘等ALP,在病理时还可能出现高分子ALP,以及一些和肿瘤有关的变异ALP,如Regan、NagaoALP等。深一步研究发现这些ALP主要受3个基因位点控制,相应生成3大类ALP,即小肠、胎盘和组织非特异ALP,后者包括临床上所谓的骨、肝、肾等组织器官,它们的氨基酸结构类似,抗原性无差别,这些酶电泳速率和对不同抑制剂反应差异来自ALP中所含糖基的不同。碱性磷酸酶广泛分布于人体的骨、肝、肠、胎盘等组织中。主要用于阻塞性黄疸、原发性肝癌、继发性肝癌、胆汁淤积性肝炎的检查。患这些疾病时,肝细胞过度制造ALP,经淋巴道和肝窦进入血液,同时由于肝内胆道胆汁排泄障碍,反流入血而引起血清碱性磷酸酶明显升高。但由于骨组织中此酶亦很活跃。因此,孕妇、骨折愈合期、骨软化症。佝偻病、骨细胞癌、骨质疏松、肝脓肿、肝结核、肝硬变、白血病、甲状腺机能亢进时,血清碱性磷酸酶亦可升高,应加以鉴别。碱性磷酸酶的升高,只说明身体内部的一些现象。并不能确认就是某种疾病。2
临床意义1.生理性增高:儿童在生理性的骨骼发育期,碱性磷酸酶活力可比正常人高1~2倍。
2.病理性升高: ①阻塞性黄疸、肝硬化、肝坏死,碱性磷酸酶明显升高(肝细胞性黄疸则升高不明显)。 ②原发性和继发性肝癌时碱性磷酸酶亦明显升高,与癌组织中或癌肿周围肝 细胞合成碱性磷酸酶增加有关。 ③其他肿瘤如乳腺癌、肺癌、卵巢癌、骨细胞瘤、骨肉瘤等,碱性磷酸酶增高时,提示可能有肝脏转移。 ④变形性骨炎、成骨细胞癌、佝偻病、骨软化、甲状腺及甲状旁腺功能亢进、肾小管性酸中毒、遗传性磷酸酶过多症 ⑤很多药物可使碱性磷酸酶增高,如巴比妥类、抗生素(红霉素、庆大霉素、氯霉素、卡那霉素、氨苄青霉素等)。
细胞合成碱性磷酸酶增加有关。 ③其他肿瘤如乳腺癌、肺癌、卵巢癌、骨细胞瘤、骨肉瘤等,碱性磷酸酶增高时,提示可能有肝脏转移。 ④变形性骨炎、成骨细胞癌、佝偻病、骨软化、甲状腺及甲状旁腺功能亢进、肾小管性酸中毒、遗传性磷酸酶过多症 ⑤很多药物可使碱性磷酸酶增高,如巴比妥类、抗生素(红霉素、庆大霉素、氯霉素、卡那霉素、氨苄青霉素等)。
3.碱性磷酸酶减低:常见于重症慢性肾炎、乳糜泻、贫血、恶病质、儿童甲状腺功能不全或减退、维生素C缺乏症坏血病)。营养不良、呆小症、遗传性低磷酸酶血症。1
研究应用ALP主要应用于分子生物学和酶免分析中:
1、分子生物学中主要用作核酸的去磷酸化。因为DNA通常会在5'端结合磷酸基团,用ALP去磷酸化能防止DNA分子5'端与3'端连接,从而在后续步骤准备好之前让DNA分子抑制处于线性化状态;同样,通过去磷酸化可用作放射标记示踪。通常用作这些目的用的最多的是Shrimp alkaline phosphatase (SAP),因为在反应完成之后它是最容易灭活的。
2、酶免分析中应用最多的是ELISA,以竞争法测小分子抗原为例,抗体先与固相载体结合,然后让待测样品与事先经ALP标记过的该抗原竞争地与抗体结合,洗去未反应的过量ALP-抗原,加入显色底物。则可以通过与按梯度浓度变化的标准品绘出的标准曲线对比从而知道待测样品中抗原的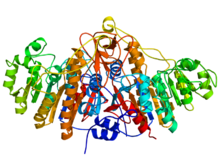 浓度。ELISA中用的比较多的是辣根过氧化物酶(HRP),底物为OPD, 深桔黄色 ,检测波长492nm;TMB, 蓝绿色,检测波长450nm 碱性磷酸酶,底物为PNPP(对-消基苯磷酸酯), 黄色 ,检测波长405nm
浓度。ELISA中用的比较多的是辣根过氧化物酶(HRP),底物为OPD, 深桔黄色 ,检测波长492nm;TMB, 蓝绿色,检测波长450nm 碱性磷酸酶,底物为PNPP(对-消基苯磷酸酯), 黄色 ,检测波长405nm
3、工业上一个普遍的应用是作为检验牛奶的巴斯的灭菌的标志:被巴斯德过高温灭菌的分子会被灭活,向其中和未巴斯灭菌的牛奶中加入ALP的底物,2分钟后未灭菌的样品应该显黄色,如果待测样品(指被巴斯灭菌过的牛奶)也能呈现相同颜色,则说明巴斯灭菌温度未过度。当然总有例外,因为有少数细菌会产生耐热的ALP。3
正常范围正常范围(连续监测法)
女性,1-12岁小于500U/L;大于15岁,40-150U/L;
男性,1-12岁小于500U/L;12-15岁,小于750U/L;大于15岁,40-150U/L。
ALP能水解多种天然存在的或合成的有机磷酸酯(底物)。在体内,ALP的直正底物尚不清楚。ALP先天缺陷的个体,中大量排出磷酸乙醇胺,推测它可能是一种真正的生理性底物。在大多数AP测定方法中,释放出的磷酸基转移给水分子,此时ALP的海促反应属水解类反应。使用某些氨基缓冲液时,ALP的催化速率增强。
一般来说,低值要比高值少见。3
检测原理1、连续监测法原理
以磷酸对硝基苯酚(4-NPP)为底物,2-氨基2-甲基一1内醇(AMP)或二乙醇胺(DEA)为磷酸能基的受体物质,增进酶促反应速率。4-NPP在碱性溶液中为无色,在ALP催化下,4-NPP分裂出磷酸基团,生成游离的对硝基苯(4-NP),后者在碱性溶液中转变成配式结构,呈现较深的黄色。在波长405nm处监测吸光度增高速率,可计算ALP活性单位。3
2、比色法原理
ALP在碱性环境中作用于磷酸苯二钠,使之水解释出和磷酸。酚在碱性溶液中与4-氨基安替吡啉作用,经铁氯化钾氧化而成红色醌的行生物,根据红色深浅确定ALP的活力。3
本词条内容贡献者为:
黄头生 - 副教授 - 华北电力大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国