简介
金属铬主要用于镍基、钴基高温合金,铝合金,钛合金,电阻合金,耐蚀合金,铁基耐热合金及不锈钢等的生产。工业生产的金属铬有两种,一种为铝热法铬,块状,银亮色,有金属光泽,含Cr>98%,根据用途对杂质有不同要求;另一种为电解铬,片状,表面暗褐,经氢气精炼后表面明亮,含Cr>99%。
简史铬是1797年法国化学家沃克兰(L.N.Vauquelin)分析西伯利亚铬铅矿时发现的。根据希腊字“xP0弘Ⅸ”(颜色)取名为chrome,即铬(chromium)。他用铬铅矿制得铬酸。并在石墨坩埚内用碳还原得到淡灰色金属。1798年克拉普罗特(w.H.Klaproth)也制得铬。由于铬与碳亲和力强,很难制得无碳金属铬。早在1856年由德维尔(S.C.Dev—ille)、弗雷迈(E.c.Fremy)和沃勒(F.W6hler)等用钠、铝和锌还原氯化铬制取纯铬。戈尔德施米特(H.Goldschmidt)在1895~1908年间用铝热法还原氧化铬的工业规模生产金属铬成功。1854年本生(W.Bunsen)报导电解氯化铬水溶液制得电解铬。1905年卡尔弗特(H.R.Carveth)和柯里(B.E.Curry)报导电解铬酸水溶液制得电解铬。这种方法在美国采用了约30年。主要问题是电效率低、能耗高和成本贵。美国矿务局经十多年的研究,于1946~1950年间多次报导电解铬一铵一矾水溶液生产电解铬的方法。并完成半工业试验,奠定了电解铬的生产工艺。1932年范·阿克耳(A.E.Van Arkel)报道用碘化铬热分解法制得高纯度铬(Cr99.99%),供特殊用途。中国自1958年开始研制金属铬。锦州铁合金厂在60年代初的半工业试验基础上建成中国铝热法金属铬生产厂。以后又改用氢氧化铬法生产氧化铬以减轻生产过程的铬害和提高铬回收率。1959年吉林铁合金厂试验铬一铵一矾水溶液电解法生产电解铬。
性质铬的原子序数为24。原子量为51.996,外层电子结构为3d54s1。熔点1875℃,沸点2680℃。密度(20℃)7.19g/cm3。铝热法铬(Cr99%)的熔化温度约为1830℃,密度约为7.2g/cm3。电解铬(Cr99.9%)的熔化温度约为1850℃,密度约为7.2g/cm3。铬为银白色,微带天蓝色的脆性金属。在300℃以下对氧、氮、湿空气都很稳定。温度升高则氧化加快,但在表面形成氧化膜后,则氧化速度减慢,至1200℃氧化膜破坏后则氧化速度加快。故在1000℃以下铬有抗氧化能力。冷盐酸、冷硝酸和硫酸对铬的作用微弱,有抗酸侵蚀特性。铬与氧生成氧化物CrO、Cr2O3和CrO3,其中Cr2O3较稳定。铬与碳生成Cr4C、Cr7C3和Cr3C2;与硅生成Cr2Si、Cr5Si3、CrSi和CrSi2。铬的硅化物比碳化物稳定,铬与氮生成CrN和Cr2N。铬与硫生成CrS。
用途铬是脆性金属不能单独作为金属材料,但与铁、镍、钴、钛、铝、铜等组成合金后,则成为具有耐热性、热强性、耐磨性及特殊性能的工程材料。金属铬用作生产各种以镍或钴为基的高温合金,钛合金,铝基合金,电阻合金和铜合金等的合金剂。部分用来生产不锈钢和耐热钢。这些材料广泛用于航空,宇航,核反应堆,汽车,造船,化工,军工等行业。
生产方法:电解法,铝硅热法,和真空碳还原法。我国金属铬生产以铝热法为主,少量采用电解法2。
制取工艺自然界的铬资源主要是铬铁矿。而生产金属铬是用氧化铬作铬原料,故整个工艺分为两步。首先用铬铁矿作原料生产氧化铬。然后用铝还原氧化铬(即铝热法)冶炼金属铬。用铬铁矿生产氧化铬首先是碱焙烧,将不溶于水的Cr3+铬盐转化为溶于水的Cr6+铬盐,即Na2CrO4,经水浸得到铬酸钠(Na2CrO4)水溶液。从铬酸钠水溶液制取氧化铬的工业方法有3种:
(1)氯化铵还原法。加入硫酸使:Na2CrO4变成重铬酸钠(Na2Cr2O7)溶液。浓缩后析出Na2SO4晶体。再将母液冷却到25℃得到重铬酸钠晶体。将重铬酸钠晶体与氯化铵混合,在700~800℃下还原得到Cr2O3和NaCl;经水洗去掉NaCl而得到氧化铬,再在约1200℃氧化煅烧脱硫得到氧化铬。
(2)铬酐热分解法。将重铬酸钠晶体与浓硫酸反应生成铬酐(CrO3),将铬酐放在高温煅烧炉内热分解成氧化铬。
(3)氧氧化铬热分解法。往铬酸钠溶液加硫磺粉或硫化钠溶液,将Cr6+还原为Cr3+,即Cr(0H)3沉淀。再经高温煅烧成氧化铬。用氢氧化铬法制取氧化铬具有工艺流程短;铬回收率高;不产生腐蚀性气体,对厂房、设备维护有利;节约大量硫酸和化工原料;副产品海波(Na2S2O3)可以回收利用;成本降低等优点。下图是用冶炼金属铬的工艺流程图。 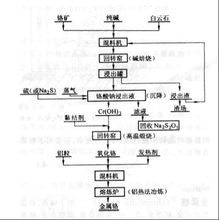




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国