基本概念
通常把在—定电流密度作用下的电极电位与相对平衡的电极电位的差值,称为电极极化。常见的有电极极化有电化学极化和浓差极化。
一个电极,在可逆情况下,电极上有一定的带电程度,建立了相应的电极电势jr。当有电流通过电极时,若电极一溶液界面处的电极反应进行得不够快,导致电极带电程度的改变,也可使电极电势偏离jr。以电极(Pt)H2(g)|H+为例,作为阴极发生还原作用时,由于H+变成H2的速率不够快,则有电流通过时到达阴极的电子不能被及时消耗掉,致使电极比可逆情况下带有更多的负电,从而使电极电势变得比jr低,这一较低的电势能促使反应物活化,即加速H+转化成H2。当(Pt)H2(g)|H+作为阳极发生氧化作用时,由于H2变成H+的速率不够快,电极上因有电流通过而缺电子的程度较可逆情况时更为严重,致使电极带有更多的正电,从而电极电势变得比jr高。这一较高的电势有利于促进反应物活化,加速使H2变为H+。将此推广到所有电极,可得具有普遍意义的结论:当有电流通过时,由于电化学反应进行的迟缓性造成电极带电程度与可逆情况时不同,从而导致电极电势偏离jr的现象,称为电化学极化。
因电化学极化而造成的电极电势jI与jr之差的绝对值,称为“活化过电势”。活化过电势的大小是电化学极化的量度1。
电极极化的规律- --Tafel方程实验表明,在电解过程中,除了Fe、Co、Ni等一些过渡元素的离子之外,一般金属离子在阴极上还原成金属时,活化过电势的数值都比较小。但在有气体析出时,例如在阴极析出H2、阳极上析出O2或C12时,活化过电势的数值相当大。由于气体的活化过电势相当大,而且在电化学工业中又经常遇到与气体活化过电势有关的实际问题,因此对其研究比较多。1905年,塔菲尔(Tafel)在研究氢气的活化过电势与电流密度I的关系时曾提出如下经验关系:
h = a + blgi
称为塔菲尔公式。其中a和b是经验常数。下表列出部分金属上析出H2时a和b的数值。
|| ||
分析表中数据可以看出,对于不同的电极材料,a值可以相差很大,而b值却近似相同,大约为0.12V(Pt、Pd等贵金属除外)。这说明不同金属上析出氢气时产生活化过电势的原因有其内在的共同性。由上式可见,氢气的活化过电势h 与lgi成线性关系,如下图所示。值得指出,当电流密度非常小时,塔菲尔公式是不适用的。
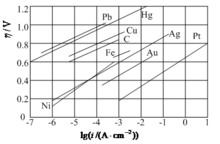
后来的研究发现,氧等气体析出时的活化过电势与电流密度的关系也有类似于塔菲尔公式的形式。
过电势的测量测量电极的过电势,一般采用如图所示的装置。带有搅拌器的电解池A中有面积已知的待测电极B和辅助电极C,经一可变电阻D与直流电源E联成回路,内接有电流计M以测量回路中的电流。改变电阻D可调节回路中电流的大小,从而调节通过待测电极的电流密度i。
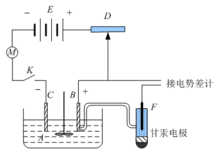
将待测电极B与电势已知的参比电极F(通常用甘汞电极)组成一个电池,接到电势差计上,采用对消法测量该电池电动势。应注意电极B、F与电势差计组成的回路上并无电流通过,因此根据E=j+-j-的关系,利用所测电动势与参比电极电势j甘汞)的数值,可算出待测电极的电势jI。jI与对应的jr相减所得绝对值就是过电势h。若测定时搅拌溶液比较充分,其值可视为是活化过电势。若不搅拌或搅拌不充分,则为活化过电势与浓差过电势之和2。
影响电化学极化的因素1、电极本身的影响,不同的电极,在相同的条件下发生电化学反应,其极化程度是不同的,由于各电极体系的i不同,a值也不同,固极化不同,其原因与构成电极的院子内部机构有关。
2、电流密度的影响,当通过电极的i增加,电化学极化增大,反之,极化减少,在实际生产中常常采用增加电极面积的方法或采用多孔电极的办法来减少i值,使极化降低。
3、温度的影响,在其他条件固定的情况下,一般升高温度,电化学极化降低,反之,电化学极化增加,这是因为温度升高,参加电化学反应的离子的能量增加,有助于克服反应的活化能垒,使反应速度加快。
4、其它因素的影响,如电解质溶液的组成,pH值得大小以及电解液中微量杂质对电化学极化都有影响3。




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国