酸指电离时产生的阳离子全部都是氢离子的化合物;碱指电离时产生的阴离子全部都是氢氧根离子的化合物;盐指电离时生成金属阳离子(或铵根离子)和酸根离子的化合物1。可以简记为:氢头酸、氢氧根结尾碱、金属开头酸根结尾的是盐。
基本介绍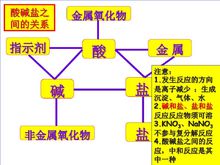 酸:电离时产生的阳离子全部都是氢离子。例如:H₂SO₄(硫酸),HCl(盐酸),HNO₃(硝酸),H₂CO₃(碳酸)
酸:电离时产生的阳离子全部都是氢离子。例如:H₂SO₄(硫酸),HCl(盐酸),HNO₃(硝酸),H₂CO₃(碳酸)
碱:电离时产生的阴离子全部都是氢氧根离子。例如 :NaOH(氢氧化钠),KOH(氢氧化钾),Ca(OH)₂(氢氧化钙),NH₃·H₂O,NH₄OH(氨水)2
盐:电离时生成含有金属阳离子(或NH₄铵根)和酸根离子的化合物。例如:Na₂CO₃(碳酸钠),CuSO₄(硫酸铜) ,NH₄NO₃(硝酸铵)
仅由氢离子和酸根离子、非金属单质结合生成的化合物为酸。
由金属离子和氢氧根离子结合生成的化合物为碱。
由金属离子和酸根离子结合生成的化合物为盐,不一定都是如此。例子如Cu₂(OH)₂CO₃碱式碳酸铜,有氢氧根
酸碱盐类化合物一定含有非金属元素。
定义在化学上,广义的盐是由阳离子(正电荷离子)与阴离子(负电荷离子)所组成的中性(不带电荷)的离子化合物
⒈和酸发生反应[复分解反应]酸+盐→新盐+新酸(强酸→弱酸)这里的盐可以是不溶性盐。但不能是不溶于酸的盐
[举例]2HCl+Na2CO3=H2O+CO2↑+2NaCl (碳酸不稳定会继续分解成水和二氧化碳)
⒉和碱发生反应[复分解反应]碱(可溶)+盐(可溶)→新碱+新盐
[举例]2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
⒊和某些金属反应[置换反应]盐+金属单质(某些)→新金属单质+新盐
反应中的金属一定要比盐中的金属活泼才可以把它给置换出来
[举例]Zn+CuSO4=ZnSO4+Cu(有一个金属活泼性顺序表,活泼性依次减弱:钾 钙 钠 镁 铝 锌 铁 锡 铅 氢 铜 汞 银 铂 金。在这个实例中,锌(Zn)的活泼性在铜(Cu)之前,所以可以把铜置换出来)3。
分类盐也分为正盐,酸式盐,中性盐,碱式盐,复盐。
正盐:单由金属离子(包括铵根离子)和酸根离子构成
酸式盐:由金属离子(包括铵根离子)、氢离子 酸根离子和非金属离子构成
碱式盐:由金属离子(包括铵根离子)、氢氧根离子 酸根离子和非金属离子构成
复盐:由不同金属离子(包括铵根离子)和酸根离子构成
碱式盐详细解释:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或铵根)的盐。
酸跟碱反应时,弱碱中的氢氧根离子部分被中和,生成的盐为碱式盐。碱式盐,二元碱或多元碱才有可能形成碱式盐。碱式盐的组成及性质复杂多样。碱式碳酸铜(也称铜绿,铜生锈后产生的物质)**[**Cu2(**OH)2CO3]和碱式氯化镁[Mg(OH)Cl]**等都属于碱式盐。碱式盐是碱被酸部分中和的产物。3
盐的种类
关于盐呈酸性碱性的口诀:"谁强显谁性"
比如强酸弱碱盐显酸性,强碱弱酸盐显碱性,
但如果是强酸强碱盐或弱酸弱碱盐就显中性。4
说明:强酸性的物质(或化合根)有: Cl (氯) (硝酸根) (硫酸根)等
弱酸性的物质(或化合根)有: (碳酸根)等
强碱类的物质(或化合根)有:Na(钠)、K(钾)等
弱碱类的物质(或化合根)有:NH4 (铵根)、Cu(铜)等
强酸强碱盐:中性(pH=7)(如:NaCl, KNO3)
强酸弱碱盐:酸性(pH7)(如:Na2CO3)
性质介绍酸的性质(1)酸+碱=盐+水 即:中和反应。
反应条件:无
反应类型:复分解反应
例:H2SO4(酸)+Mg(OH)2(碱)=MgSO4(盐)+2H2O(水)
(2)酸+盐=新酸+新盐
反应条件:有气体或者弱电解质或者沉淀生成才能反应
反应类型:复分解反应
例:2HCI(酸)+Na2CO3(盐)=H2CO3(新酸)+2NaCl(新盐)
但是碳酸不稳定:H2CO3=H2O+CO2↑这样就有气体和水生成了
(3)酸+活泼金属=盐+氢气
反应条件:金属是活泼金属
反应类型:置换反应
例:2HCl(盐酸)+Fe(活泼金属)=FeCl2(盐)+H2↑(氢气)
(4)酸+金属氧化物=盐+水
反应条件:无
反应类型:复分解反应
例:H2SO4(酸)+CuO(碱性氧化物)=CuSO4(盐)+H2O(水)
口诀:钾钠铵盐硝酸盐,全能溶于水中间
盐酸盐不溶银亚汞,硫酸盐不溶钡和铅
碳酸盐类多不溶,易溶只有钾钠铵
碱类能溶钾钠钙钡铵
诸酸多溶解,硅酸不在内
碱的性质(1)酸+碱=盐+水 即:中和反应。
反应条件:无
反应类型:复分解反应
例:H2SO4(酸)+Mg(OH)2(碱)=MgSO4(盐)+2H2O(水)
(2)碱+盐=新碱+新盐
反应条件:碱和盐必须都溶于水,有沉淀生成(二者同时满足)
反应类型:复分解反应 条件:反应有沉淀或有弱电解质或有气体生成。(简记:上“↑”、下“↓”、水“H2O)
例:Ca(OH)2(碱)+K2CO3(盐)=CaCO3↓(新盐)+2KOH(新碱)
(3)碱+一些非金属氧化物=盐+水
反应条件:非金属氧化物是酸性氧化物
反应类型:复分解
例:Ca(OH)2(碱)+CO2(非金属氧化物)=CaCO3↓(盐)+H2O(水)
此反应用于鉴别CO2。
盐的性质(1)酸+碱=盐+水 即:中和反应。
反应条件:无
反应类型:复分解反应
例:H2SO4(酸)+Mg(OH)2(碱)=MgSO4(盐)+2H2O(水)
(2)碱+盐=新碱+新盐
反应条件:碱和盐必须都溶于水,有沉淀生成(二者同时满足)
反应类型:复分解反应 条件:反应有沉淀或有弱电解质或有气体生成。(简记:上“↑”、下“↓”、水“H2O)
例:Ca(OH)2(碱)+K2CO3(盐)=CaCO3↓(新盐)+2KOH(新碱)
(3)盐+盐=新盐+新盐
反应条件:盐必须都溶于水,生成物中有沉淀(二者同时满足)
反应类型:复分解
例:BaCl2+Na2SO4=BaSO4↓+2NaCl
这是一个沉淀的反应
(4)盐+某些金属=新盐+新金属
反应条件:盐能溶于水,金属的活动性比盐中的大(二者同时满足)
反应类型:置换
例:CuSO4(盐)+Fe(金属)=FeSO4(新盐)+Cu(新金属)
但是有些金属无法实现此反应,即除钾钙钠以外,因为他们和水就反应了3
通性酸
有腐蚀性,溶液呈酸性,能与活泼金属发生反应,碱,某些盐和金属氧化物反应 与排在氢之前的活泼金属反应生成盐和氢气 ,与指示剂反应,pH显酸性的溶液不一定是酸,但是酸一定是酸性溶液(即显酸性)。
碱
有腐蚀性。溶液呈碱性,能与酸,某些盐,非金属氧化物反应 ,某些碱能与某些金属氧化物反应,与指示剂反应 碱性溶液不一定是碱,但是碱一定是碱性溶液。(显碱性的溶液不一定都是碱溶液,即所谓的碱;但碱,一定显碱性,即pH值大于7。)
盐
有些盐有微弱的腐蚀性,溶液的酸碱度根据盐的性质判定,能与某些酸,碱,盐反应
还能和其他某些化合物反应1
相互反应(1)金属单质+酸 --------盐+氢气 (置换反应)
(2)金属单质+盐(溶液) -------另一种金属+另一种盐
(3)碱性氧化物+酸 --------盐+水
(4)酸性氧化物+碱 --------盐+水
1.苛性钠(强碱)暴露在空气中变质:2NaOH+CO2=Na2CO3+H2O
2.苛性钠吸收二氧化硫气体:2NaOH+SO2 =Na2SO3+H2O
3.苛性钠吸收三氧化硫气体:2NaOH +SO3=Na2SO4+H2O
4.消石灰放在空气中变质:Ca(OH)2+CO2=CaCO3 ↓+H2O
(5)酸+碱--------盐+水
1.盐酸和烧碱反应:HCl + NaOH=NaCl+H2O
2.硫酸与氢氧化钠反应:2NaOH+H2SO4=Na2SO4+2H2O
3.酸和氢氧化铜反应:2HCl + Cu(OH)2=CuCl2+2H2O
(6)酸+盐-------另一种酸+另一种盐
1.大理石与稀盐酸反应:CaCO3+2HCl=CaCl2+H2O+CO2↑
2.碳酸钠与稀盐酸反应: Na2CO3+2HCl=2NaCl+H2O+CO2↑
(7)碱+盐-------另一种碱+另一种盐
1.氢氧化钠与硫酸铜:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2.氢氧化钠与氯化铁:3NaOH+FeCl3 =Fe(OH)3↓+3NaCl
3.氢氧化钠与氯化镁:2NaOH+MgCl2=Mg(OH)2↓+2NaCl3
本词条内容贡献者为:
包申旭 - 教授 - 武汉理工大学




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国