间隙化合物的分类
由原子半径较大的过渡族金属元素和原子半径较小的准金属元素H,B,C,N,Si等形成的金属间化合物称为间隙化台物或间隙相。因为在这种化合物中准金属原子是位于金属结构的间隙中:间隙相也称Hagg相,因为Gunnar Hagg对这类化合物进行过系统的研究。
间隙相通常可用一个化学式表示,并具有特定的结构。此结构往往不同于纯组元的结构,而是取决于准金属元素X与过渡族金属元素M的原子半径比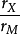 。Hagg指出:
。Hagg指出:
当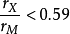 时,形成结构简单的间隙相,并具有简单的化学式MX,M2X,M4X和MX2。
时,形成结构简单的间隙相,并具有简单的化学式MX,M2X,M4X和MX2。
当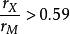 时,形成结构复杂的间隙相,其典型的化学式为M3C、M23C6和M6C,但也可有少数其它类型。这里M可以是一种金属元素,如Fe3C,也可以是两种或多种金届元素
时,形成结构复杂的间隙相,其典型的化学式为M3C、M23C6和M6C,但也可有少数其它类型。这里M可以是一种金属元素,如Fe3C,也可以是两种或多种金届元素
Hagg还指出,当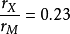 时,准金属原子占据过渡族金属结构的四面体间隙;而当
时,准金属原子占据过渡族金属结构的四面体间隙;而当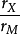 在0.41鄯0.59之间时则占据八面体间隙。在有些文献上,将上述区分间隙化合物的规则称为Hagg规则。根据Hagg规则不难理解:
在0.41鄯0.59之间时则占据八面体间隙。在有些文献上,将上述区分间隙化合物的规则称为Hagg规则。根据Hagg规则不难理解:
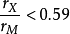 1.由于氧和氨原子的半径比较小(rH=0.046nm,rN=0.071nm),故所有过渡族金属的氢化物、氮化物都满足靠,因而都是简单间隙相;
1.由于氧和氨原子的半径比较小(rH=0.046nm,rN=0.071nm),故所有过渡族金属的氢化物、氮化物都满足靠,因而都是简单间隙相;
2.由于硼原于半径较大(rB=0.097nm),故所有过渡族金属的硼化物都是复杂间隙相;
3.由于碳原子具有中等大小的原子半径(rC=0.077nm),故原子半径较大的过渡族元素(族数小或周期族数大的过渡族元素)的碳化物是简单的间隙相,例如VC,WC,TiC等,而原子半径较小的过渡族元素(族数大或周期数小的元素)的碳化物则是复杂间隙相。1
间隙化合物的结构比值大于0.59的间隙化合物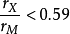 的金属原子大多位于面心立方或密排六方结构(少数情况下为体心立方或简单六方结构)的位置,小的非金属原子位于结构的间隙。通常这类间隙化合物对应于简单的分子式MX、M2X、M4X、MX2,但实际成分常常有一定的范围,与间隙的填充程度有关。
的金属原子大多位于面心立方或密排六方结构(少数情况下为体心立方或简单六方结构)的位置,小的非金属原子位于结构的间隙。通常这类间隙化合物对应于简单的分子式MX、M2X、M4X、MX2,但实际成分常常有一定的范围,与间隙的填充程度有关。
MX通常具有NaCl型或闪锌矿型结构,例如ZrN、TiN、VN、ZrC、TiC、TaC、VC、ZrH、TiH等。金属原子位于面心立方结构的结点位置,非金属原子在八面体间隙位置(NaCl型结构)或闪锌矿型结构中的硫原子位置。
M2X通常具有Fe2N型结构,例如Cr2N、Mn2N、Nb2N、Ta2N、V2N、W2C、Mo2C、Ta2C、V2C、Nb2C等。金属原子位于密排六方结构的结点位置,非金属原子在八面体间隙位置,如图所示。
比值大于0.59的间隙化合物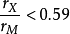 。铬、锰、铁、锆的碳化物中,
。铬、锰、铁、锆的碳化物中,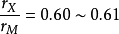 ,因此形成结构复杂的间隙化合物,铁的硼化物也是如此。
,因此形成结构复杂的间隙化合物,铁的硼化物也是如此。
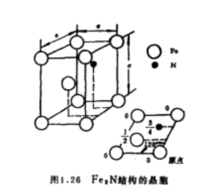
Fe3C(渗碳体)是铁碳系中一个重要的相,具有正交结构,一个晶胞有16个原子,其中12个铁原子,4个碳原子。图a为Fe3C晶胞在xy平面上的投影,图中还标出了各原子的z轴坐标。可以把由六个铁原子构成的三角棱柱看成是Fe3C的结构单元,每个三角棱柱内有一个碳原子,如图b所示。图中给出四个相邻晶胞的原子在xy平面上的投影,从 方向往下看,这些三角棱柱在晶胞z轴方向分成两层(上而一尻用实线表示,下而一层用虚线表示),每层的三角棱柱有两种取向。2
方向往下看,这些三角棱柱在晶胞z轴方向分成两层(上而一尻用实线表示,下而一层用虚线表示),每层的三角棱柱有两种取向。2
间隙化合物的特性间隙化合物,特别是简单的间隙化台物,具有以下一些特性:
1.虽然原子半径比是决定结构的主要因素,因而这种化合物也可归为尺寸因素化合物,但价电子浓度因素对结构也有很大的影响。这就是为什么当金属组元M是BCC时,间隙化台物MX往往是FCC或CPH,而不是X原子填在BCC点阵间隙中。已发现,简单间隙相的结构和价电子浓度有很好的对应关系。
2.虽然间隙化合物可以用一个化学式表示,但大多数间隙化合物的成分可以在一定的范围内变化。显然,当某类间隙被准金属原子填满时成分就达到了上限。此外,许多间隙相还具有很宽的相互固溶范围,甚至形成连续固溶体。例如,由Ti,Zr,V,Nb,Ta的碳化物彼此形成的二元系几乎都具有完全固溶范围,Ti,Zr,V,Nb的氮化物也足这种情况。
3.虽然间隙化合物中准金属元素的含量很高,但它仍具有明显的金属性质。例如有金属光泽,较好的导电性、正的电阻温度系数等。
4.间隙化合物一般具有很高的熔点、极高的硬度和脆性。这种化合物弥散在钢中就使钢硬化,耐磨。高速切削工具钢的耐磨性就来源于多种间隙化合物的共同作用。
5.间隙化合物中的结合键是混合型的:金属原子之间是通过d电子形成金属键,而金属与准金属原子之间则通过金属的d电子和准金属的p电子形成很强的定向(八面体)共价键。金属键决定了间隙化合物的明显金属性质,共价键则决定了它的高熔点、高硬度和脆性。
6.某些间隙化合物具有超导性,如NbC0.3N0.7。非超导材料Pd,Pd-Ag和Pd-Cu在加入间隙元素H后也变成超导材料。
7.过渡族金属的硼化物和磷化物可通过快冷而成为非晶态材料,其力学和电学性能类似于钢。1




 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国