近日,2022 年诺贝尔化学奖授予「点击化学和生物正交化学」,这也是夏普莱斯(K. Barry Sharpless)第二次获奖。
生物正交化学?em,这是一个很奇怪的名字。今天就来说一点个人的理解。其实,所有的科研都是为了更好地服务人类,此次的生物正交化学也不例外,其目的是为了追踪生命的精细变化,为精准药物更好的服务。
01,追踪生命的精细变化
精准是个很重要的词汇,举个通俗的例子,现在的药物,基本上做不到“头痛医头脚痛医脚”的精准性,很多时候都是全身体扩散的。无论是头痛、牙疼还是局部炎症,一般情况下吃药都是口服或者注射,口服的顺着食管到达肠胃消化吸收然后随着血液全身跑,注射是到了肌肉然后随着血液全身跑,很多时候估计你都觉得浪费了。
精准化,是一个追求。

对于细胞同样如此,细胞,其实很复杂,里面估计几万甚至几十万个分子存在,有蛋白质,核酸,糖类等等。你丢点药物进去,它到底和谁发生关系了,一脸懵。
所以这就诞生了著名的示踪法,就是追踪某一个成分的活动过程。
不过,这不容易。
02,示踪法
第一代示踪法叫同位素标记,可以追踪总蛋白质和核酸。
我们高中生物就学过,赫尔希(A.Hershey)、蔡斯(M.Chase)以大肠杆菌T2噬菌体为材料,将噬菌体的外壳和DNA分别以不同放射性同位素标记,通过同位素示踪法证明了DNA是真正的遗传物质。

但是,这个方法有一些缺陷。
首先,这对于实验室要求很高,需要配备专门的设备。
其次,同位素,有辐射风险
第三,也是最重要的一点,它追踪的物质是很宏大的分类,比如蛋白质、DNA,可是人体蛋白质很多啊,比如一个细胞可能就有几千种蛋白,如果我们需要盯着某个具体蛋白,不好意思,做不到。
第二代示踪法之一:荧光蛋白标记,追踪蛋白
这个时候,有人就提出了,能不能单独针对某个蛋白质进行标记。这就是2008年获得诺贝尔化学奖的研究内容,荧光蛋白。通过一段基因编码某种带颜色的蛋白,然后把这段基因和我们需要研究的基因连在一起,于是就可以让我们研究的蛋白出现荧光。
目前荧光蛋白已经有很多了,如下图所示。
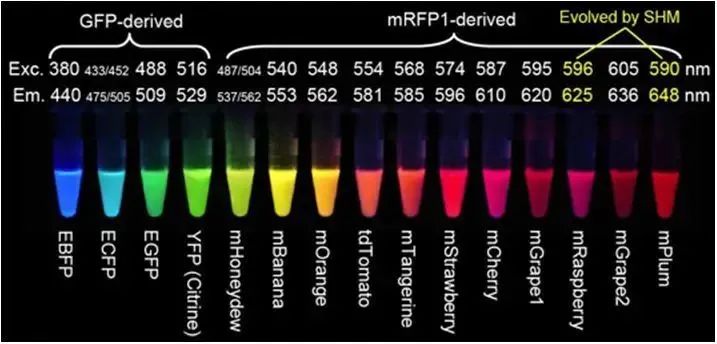
这个办法基本上是当前生命科学的最主流办法了,估计大家看各种文章都能看到荧光蛋白的踪迹。
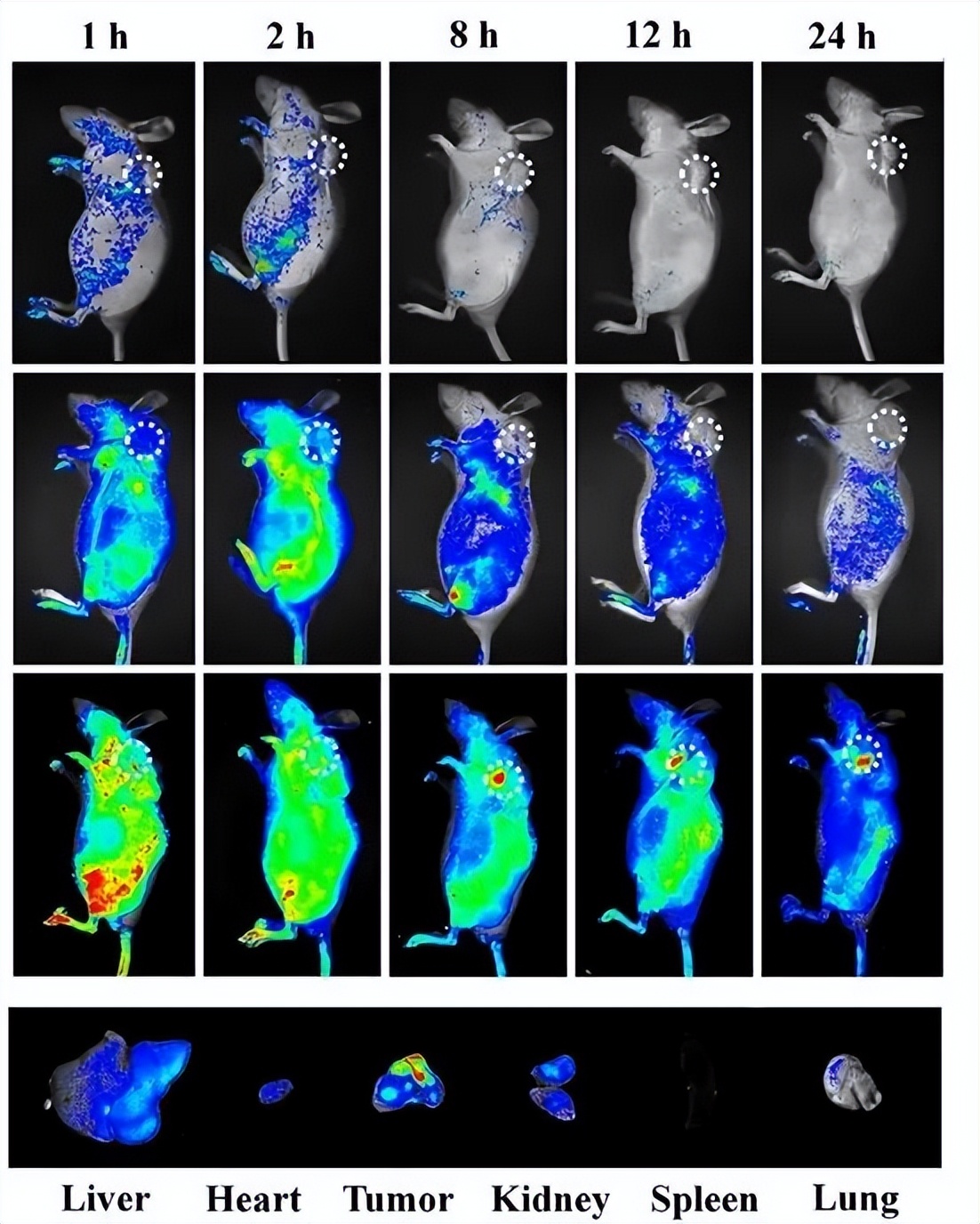
不过,这个方法,也有一点问题,那就是,荧光蛋白是基因编码的,其实也是个大分子了,本身可能就会导致你关注的蛋白质因此而发生结构改变。那么,这个结构改变的蛋白会不会对实验造成影响就是个值得关注的问题了。
第二代代示踪法之二:单分子荧光成像
SMD(Single Molecule Fluorescence Detection),看这名字就知道,追踪单分子的,也很符合我们的需求。通过对单分子的光谱性质进行测量,从而对化学反应的途径进行实时监测
这个很不错,但是已经拿诺奖了,当时还有人探讨过做这个方向的庄小威为啥就没拿到诺奖。
03,本次诺奖内容——生物正交化学
个人觉得,这次诺奖也属于第二代示踪技术之一。不过,这个技术的优势是,示踪的东西更小。
如下图,那么小小的一个基团,比荧光蛋白小太多了(成百上千的比例)。
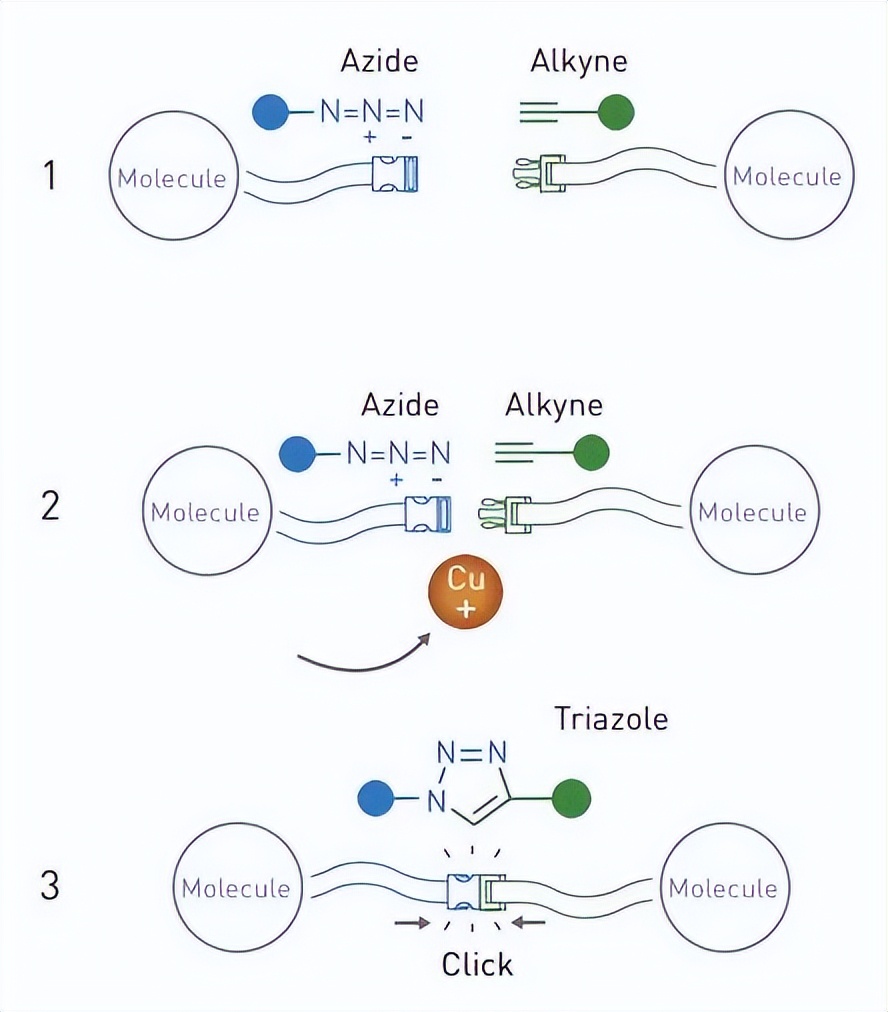
然后这个基团就可以示踪了。
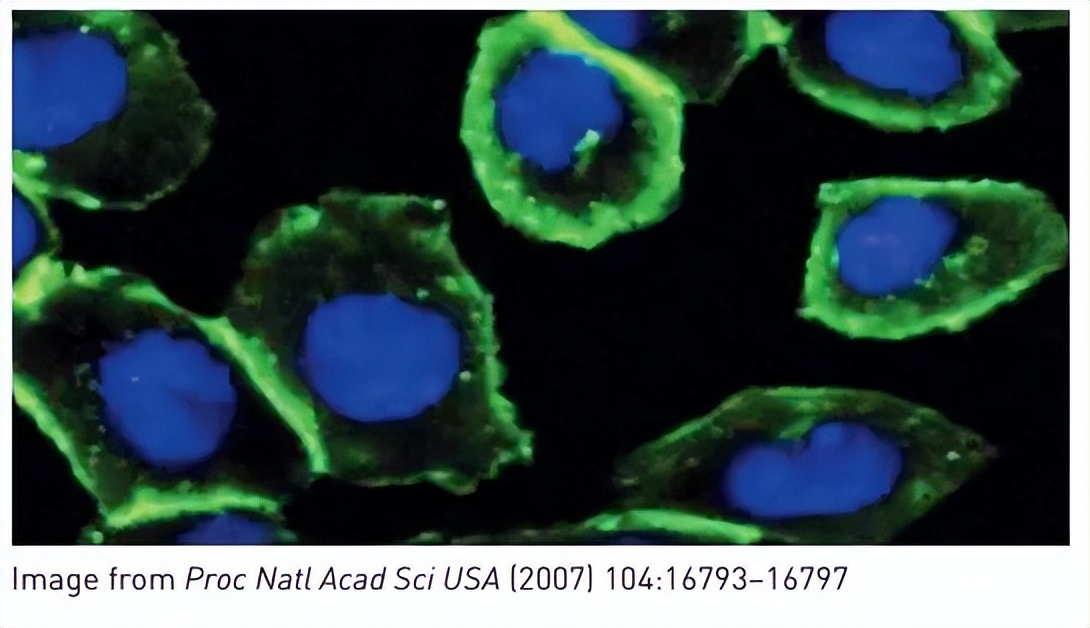
这个实验把追踪带来的影响进一步降低了,就是既要看得到,又尽可能地减少对整个细胞的干扰。
最初这个是用于糖类的追踪,目前已经用于多种大分子了。
04,不只是示踪
既然示踪是给某个分子加上了某种基团实现的,那么,这就意味着,这是一个开关,也就是click这个词的精妙之处。而既然是开关,那就意味着,这能够对分子进行直接影响,于是不仅可以用于追踪,还能直接触发反应,而这,就是精准药物的前提。
我们可以想象,我们的药物到了某个地方,但是只是在那里,然后我们根据需求,在某个时间点,加入一个小分子成分,然后啪嗒一下,二者结合,于是开启了反应,就像定时炸弹一样来选择。
这就是这种开关的新用途,就像下图所示
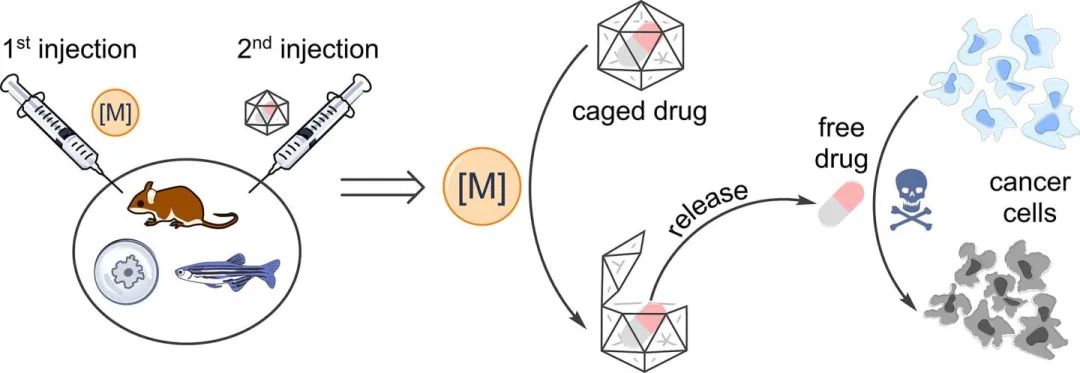
当然,这是理论上的,算是一种思路角度的开拓,具体还要看应用过程优化。







 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国