-引子
上一篇讲到,纳米机器人是尺寸在纳米到微米尺度的一种微型器械,和病毒、细菌、细胞大小差不多。它能够在血液中游弋,实时监测我们身体的状况,并在发现问题时,像医生一样帮我们治疗。
纳米机器人医生的工作有两大挑战。一方面,微纳米尺度的水显得非常粘稠,所以需要开发让纳米机器人高效运动的新方法。另一方面,狂野的水分子又会不断撞击纳米机器人,产生的布朗运动,这让纳米机器人的控制变得异常困难。
除了这两个根本的困难之外,因为人体的特殊性与复杂性,纳米机器人医生还会遇到形形色色的挑战。在这篇文章中,我们假设纳米机器人要向肿瘤递送药物,以此作为一个假想任务,来介绍纳米机器人医生工作中面临的主要挑战。
(注:本文内容根据作者英文综述改编,请参见: Wei Wang* and Chao Zhou, A Journey of Nanomotors for Targeted Cancer Therapy: Principles, Challenges, and a Critical Review of State-of-The-Art, Adv. Healthcare Mater., 2020, 10(2), 2001236)
一、肿瘤靶向药物递送
癌症是全球主要死亡原因之一。2022年国家癌症中心发布的最新数据表明,2016年中国新发癌症病例约406.4万例,新发癌症死亡病例241.35万例。最近有研究预测,2022年我国癌症的新发病例将上升为482万例[Xia, Changfa, Xuesi Dong, He Li, Maomao Cao, Dianqin Sun, Siyi He, Fan Yang et al. "Cancer statistics in China and United States, 2022: profiles, trends, and determinants." Chinese medical journal 135, no. 05 (2022): 584-590.]。随着中国居民生活和医疗水平的不断提高,癌症的发病率仍会继续上升。因此,对癌症的治疗成为当代中国人无法回避的一个医疗问题。
化疗是一种利用药物杀死癌细胞的方法,是目前治疗癌症的主要手段之一。目前医院广泛采用的化疗大概可以认为是化疗1.0版本:随着血液循环,药物运送到每一个细胞附近;然而抗癌药物往往不分敌我,导致杀敌一千自损八百,从而造成极大的副作用,甚至影响疗效。
目前很受关注的靶向药是化疗的2.0版本,其作用机制简单来说,就是通过精确的设计药物分子或者药物的载体,使药物更多的作用于癌细胞,而更少的伤害正常细胞,从而减小副作用、提升对癌细胞的杀伤。
这个概念非常棒,但效果仍然有限。原因之一,是肿瘤内部环境往往十分复杂,既有错综复杂的血管、种类繁多的细胞,还有层层交织在一起的纤维蛋白。更有甚者,有些肿瘤中心的水压还比外面大。这一如同热带雨林一般纷繁复杂的环境,让药物分子很难有效扩散到整个肿瘤内部。而如果没办法杀死全部的癌细胞,就有可能复发、转移,甚至产生抗药性。
纳米机器人这种能够自主运动的智能载体为解决上述困难提供了全新思路:将药物分子装载在纳米机器人上,通过它的高效运动和辗转腾挪,克服种种艰难险阻,在“热带雨林”里开辟出一条道路,从而把药物准确、高效的递送到每一个癌细胞。
这或许是癌症化疗的3.0版本:携带着抗癌的药物的纳米机器人医生像是一台精确制导的货车,在血液中遨游,寻找到肿瘤,穿透层层阻碍,把药物精准的运送到癌细胞附近或者癌细胞内。在杀死癌细胞的同时,尽可能少的伤害正常的细胞。
相比起化疗v1.0、2.0,以纳米机器人为载体的靶向递送极大的增加了药物递送效率,因而有望极大的提高药物效果,并减小副作用。此外,还可以给纳米机器人安装检测、成像、切削、加热等多种功能模块,让机器人不仅仅作为“快递员”,还可以像外科医生、影像科医生、检验科医生、介入科医生等多学科会诊一样,大幅提升诊疗效果。
这样的场景非常诱人,但至今仍然停留在纸面。究竟是什么阻碍了纳米机器人医生从实验室转化到临床,最终应用在我们的体内?下面,就让我们跳上一台纳米机器人,跟着它钻到人体血液中,来一场向肿瘤靶向递送药物的惊心动魄的旅程。让我们亲身经历它所遇到的困难,理解它的“不易”。
二、生物相容性
生物相容性,是指植入体内的材料是否会引起身体的排异反应,是否会释放有毒有害的化学物质,是否会影响正常的生理功能。纳米机器人就是一种植入性材料。一方面,它是体内的异物,所以我们的身体会积极的去清除它;另一方面,它也可能会对身体产生毒害。因此,让纳米机器人能够尽可能久的在我们身体中存活下来,并且维持原有的功能,还不对身体造成额外的伤害,是实现纳米机器人医生诊疗的先决条件。
我们从身体对机器人的清除,和机器人对身体的影响这两方面来进行讨论纳米机器人的生物相容性:
首先,我们体内的免疫系统无时无刻不在警惕着外来入侵者。因此,从注入身体的一瞬间开始,纳米机器人就开始了一场没有硝烟的战争。说来讽刺:纳米机器人明明是来治病救人的,但人的身体却对它没什么好脸色。毕竟,我们的身体并不知道它是何方神圣,突然侵入身体后,自然会面临着身体的排斥。不论是例如白细胞这样的主动防御系统,还是肝、肾这样的脏器,都有很大几率会捕获在血液中游弋的纳米机器人。有研究表明[Wilhelm, Stefan, Anthony J. Tavares, Qin Dai, Seiichi Ohta, Julie Audet, Harold F. Dvorak, and Warren CW Chan. "Analysis of nanoparticle delivery to tumours." Nature reviews materials 1, no. 5 (2016): 1-12.],输入人体的纳米粒子中,99%以上会被人体清除,只有1%能够到达肿瘤附近。
想象一下,和你一起进入身体的众多纳米机器人医生,就好像诺曼底登陆的士兵一样,还没有来得及施展拳脚,就出师未捷身先死。成功到达病灶的同伴,十不存一。这是何等悲壮和无奈呀。
还好,科学家已经在努力解决这个问题了,而主要的思路就是在纳米机器人医生表面覆盖一层特殊的涂层,让免疫系统对它视而不见,或者认为是身体的一部分而欣然接受。这样的涂层可以是人工合成的高分子(例如聚乙二醇),甚至也可以是人体中的细胞膜。例如,美国加州大学圣地亚哥分校的张良方教授团队,就开发了一种把红细胞膜剥离下来,再包裹在人工合成的微纳米粒子表面的方法[Hu, Che-Ming J., Li Zhang, Santosh Aryal, Connie Cheung, Ronnie H. Fang, and Liangfang Zhang. "Erythrocyte membrane-camouflaged polymeric nanoparticles as a biomimetic delivery platform." Proceedings of the National Academy of Sciences 108, no. 27 (2011): 10980-10985.]。通过这样的“障眼法”,可以让我们的纳米医生伪装成体内的细胞,从而在体内呆的更久。
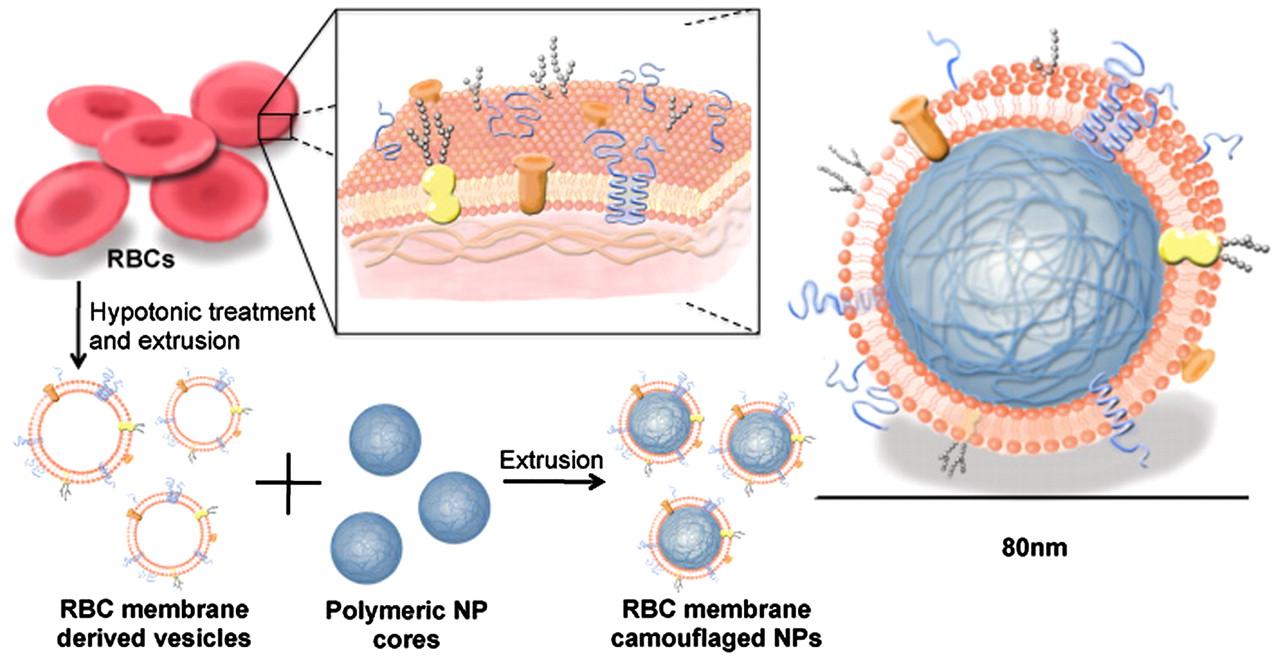
取红细胞膜包裹高分子纳米粒子的方法示意图【来源:Hu, Che-Ming J., Li Zhang, Santosh Aryal, Connie Cheung, Ronnie H. Fang, and Liangfang Zhang. "Erythrocyte membrane-camouflaged polymeric nanoparticles as a biomimetic delivery platform." Proceedings of the National Academy of Sciences 108, no. 27 (2011): 10980-10985】
但即便解决了排异问题,仍然不能确保“存活”下来的纳米机器人还“健康”:就好像到泥水里游泳,出来后浑身就沾满了污泥一样,在血液中游泳的纳米机器人,很容易被血液中蛋白质、多糖等各类大分子粘附在表面,形成一层所谓的“蛋白冠”。虽然这样的“蛋白冠”并不“脏”,但为了具备驱动、传感、控制、成像等功能,纳米机器人的表面往往修饰了特定的化学物质,而蛋白冠会遮挡纳米机器人的表面,从而影响其功能。对这一方面的研究,才刚刚开始[Protein corona formation around biocatalytic nanomotors unveiled by STORM, 10.26434/chemrxiv-2021-rhtps]。
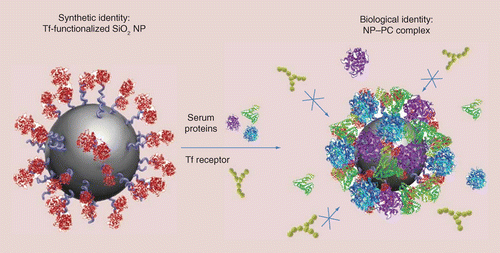
蛋白冠(右)示意图【来源:Corbo, Claudia, Roberto Molinaro, Alessandro Parodi, Naama E. Toledano Furman, Francesco Salvatore, and Ennio Tasciotti. "The impact of nanoparticle protein corona on cytotoxicity, immunotoxicity and target drug delivery." Nanomedicine 11, no. 1 (2016): 81-100.】
除了身体对纳米机器人的“伤害”之外,我们还要关注纳米机器人对身体的危害。一方面,纳米机器人的材料可能会在体内释放出铝、铜、铁,以及金、银、铂等重金属离子,甚至自由基等可能对细胞产生毒害的化学物质。另一方面,纳米粒子可能会特异性的富集在某些器官,或者进入细胞内部。这些效应,可能造成组织器官形态和功能的改变、生长发育迟缓、细胞形态改变、染色体损伤、细胞分裂异常、细胞死亡(凋亡)等后果[纳米材料的生物安全性研究进展, 东北师范大学,任德香]。
纳米材料的生物毒副作用是近年来收到广泛关注的前沿研究,但目前对纳米材料生物毒性的机理仍然缺乏深入、系统的研究。因此,在把纳米机器人应用在临床诊疗之前,还需要仔细、严肃的探讨它的生物安全性。
三、驱动
解决了生物相容性这个头等大事,就好像获得了在体内长期工作的“签证”,我们乘坐的纳米机器人终于可以扬帆起航,大展拳脚了!
且慢,我们的“帆”在哪里?换句话说,纳米机器人在身体里如何运动呢?
上一篇文章已经说过,在微纳米尺度,宏观的驱动机器运动的方式已经失效了,需要开发新的驱动机制。二十年来,科研人员主要开发了两大类方法来驱动纳米机器人。
第一类是通过化学反应,将化学燃料转化为机械动能。这可能是最容易想到的驱动方式之一,毕竟宏观的发动机绝大多数都是这么工作的,从而驱动了火箭、飞机、燃油车。实验室里的一个典型的体系,是纳米机器人可以把过氧化氢分子催化分解为水和氧气。然后或是通过释放氧气气泡,或是通过产生的化学物质的浓度梯度,机器人一秒钟可以前进几十甚至上百个身长。博尔特的奔跑速度大约是10米/秒,即每秒约5个身长。这么一看,纳米机器人简直就是飞火流星一般。

气泡驱动的纳米管机器人示意图【来源:https://www.chemistryworld.com/news/bubble-powered-microengines-push-forward/3000654.article】
可一到了身体里,结果往往就变得惨不忍睹。例如,过氧化氢是个非常好的燃料,但有毒,因此不能够用于在体内驱动纳米机器人。而其他在身体里能够利用的燃料种类十分有限,而且浓度通常很低,纳米机器人可能会有心无力,运动迟缓。
还有另一个更微妙的问题:一些化学驱动的纳米机器人只能在很干净的水中才能动的比较快,而对于溶液中是否有离子却十分敏感。我们的体液中离子浓度其实很大(大约100 mmol/L,可以尝尝生理盐水的味道就知道有多咸了)。在这样的高盐环境里,许多纳米机器人寸步难行,甚至还有可能因为高离子浓度削弱了颗粒彼此的静电排斥,而彼此粘成一团。
综上,利用化学燃料驱动纳米机器人,理论上十分可行,实验室也有很好的结果,但想在体内实际用,却困难重重。
就如同汽车一样,除了燃料驱动,还可以用电驱动。基于类似的思路,还可以开发利用电磁场、光,甚至超声波这样的“外场”驱动的纳米机器人。这些驱动方法不需要化学物质,因此不存在体内燃料浓度不足,或者有化学毒性的问题。此外,也容易开关和控制驱动力的大小。
然而,每一类外场驱动的纳米机器人,也都有自己独特的需求和缺陷。例如,如果需要驱动纳米机器人在体内各处游走,可能需要把人放在一个尺寸和强度都很大的电磁场中,一方面装置复杂,一方面也会有健康隐患。
而光驱动的纳米机器人似乎装置简单,但对于光的波长和强度都有一定的要求,而且也需要光能够穿透皮肤,或者通过光纤进入体内来给纳米机器人功能,这些都不容易实现。
最后,兆赫兹的超声波广泛用于超声成像,生物相容性好,驱动效率高。但超声波驱动纳米机器人仍然是一个新的研究方向[Liqiang Ren, Fernando Soto, Luyang Huang, and Wei Wang*, "Ultrasound-Powered Micro-/Nanorobots: Fundamentals and Biomedical Applications." Field-Driven Micro and Nanorobots for Biology and Medicine. Springer, Cham, 2022. 29-60.],在可控性、超声波装置的搭建等方面,与实际应用仍有一定距离。
做个简单的总结:虽然在体外有很多方法可以让纳米机器人运动起来,但是在体内这个复杂的环境中,能够让纳米机器人高效运动的方法不多。目前比较有应用前景的主要是磁驱动和超声驱动两种方法,但仍然有设备的小型化和柔性化、更高的能量转化效率等问题需要解决。
此外,这两类驱动的共性问题是,一群纳米机器人常常是被同时驱动和控制的,缺乏自主运动的能力;也容易在驱动过程中产生额外的吸引、排斥作用力,从而让一群机器人的分工和协作变得困难。
四、控制
不论纳米机器人怎么驱动,要想让它准确的到达目的地,都需要控制其运动方向和速度。然而,纳米机器人的尺度非常小,所处的环境又非常复杂,控制面临以下至少三方面的挑战。
首先,上一篇文章提过,对于微纳米粒子来说,水分子对其猛烈、持续、不均匀的撞击会产生“布朗运动”,让纳米机器人无规则的运动。因此,即便我们寻找到了合适的驱动和控制方法,仍然无法避免纳米机器人在血液中四处乱撞,充其量能够让它跌跌撞撞的沿大致的路线前进。这可能导致纳米机器人无法在复杂的毛细血管网络中找到正确的道路。
其次,正是因为体内环境十分复杂,就需要能够实时监控纳米机器人的位置,并精确的控制它运动的轨迹。然而纳米机器人实在是太小了,目前的体外成像手段,不论是核磁共振(MRI)还是断层扫描(CT)都很难对微米以下的粒子精确的成像,更别提追踪机器人的快速移动了。
第三,即便我们开发了能够精确控制纳米机器人的方法,也能够实时的观测和指挥它,这仍然只适用于控制一个纳米机器人。而每次注入体内的纳米机器人可能数以亿万,如何一起控制这么大量个个体呢?它们彼此的差异性是否会造成有些控制得很精确,但有的却不听号令,甚至背道而驰?
另一方面,自发运动的个体间会由于各种各样的相互作用,产生类似于鱼群、鸟群一样的动态集群运动,或者自发的形成团簇。这被称为“涌现”,是近年来复杂科学研究的关键问题[参见“从生命起源到流行病:复杂系统中的多尺度涌现现象”, Oriol Artime等 集智俱乐部,https://m.thepaper.cn/baijiahao_19391184]。那许许多多的纳米机器人是否也会涌现出这样的集群行为,这对于实现他们原定的功能又有什么影响?这些围绕纳米机器人的“集群控制”方面的问题,是目前学术界最前沿的奥秘,吸引着大量研究人员,但仍然没有成熟的答案。
综上,纳米机器人做布朗运动,轨迹混乱;尺寸微小,难以实时成像、操控;个体间相互作用复杂,集群控制方法仍然欠缺。这些困难极大的制约了纳米机器人在临床的应用。
请注意,以上的几个控制的难点都建立在一个前提:纳米机器人需要人的操控和导航。既然直接操控遇到这么多的困难,我们是不是可以模仿自然界生物的导航方法,让纳米机器人在复杂的环境中自己找到目的地(“自寻的”)?
例如,细菌、细胞和蚂蚁都可以通过感知环境中的化学物质浓度梯度,来向某个方向定向移动。这叫做“趋化性”(chemotaxis)。如果纳米机器人具有趋化性,或许可以在血液中远远地“闻”到病灶的“味道”(科学的来讲,是感受到病灶附近某些化学物质的浓度较高或者较低),然后偏转自己的运动方向,游向病灶。
这并不是天方夜谭:亿万个精子就是这样一路逆流而上,顺利的找到远隔千山万水的卵子的。既然精子可以,为什么纳米机器人不行呢?
-结语
你所乘坐的纳米机器人躲过了免疫系统的“追杀”,在血液的大分子、蛋白质中“出淤泥而不染”;又通过趋化性,从无数个大大小小的分岔路中漂洋过海,终于到达了肿瘤附近。
然而,这还只是医生到达了病床前,真正的治疗还尚未开始:
如何确保纳米机器人能够穿过“热带雨林”,进入到肿瘤的中心?
如何把纳米机器人携带的药物精准的输送到癌细胞内?
如果机器人有额外的诊疗工具,如何正确的开启它们?
如果不同的机器人有不同的药物或者诊疗功能,如何分别操控它们?
治疗结束后,又如何让纳米机器人功成身退,还是在原地无毒无害地降解?
这些问题的任何一个,难度都一点也不亚于我们上面提到的几个困难。虽然科学家们已经在实验室内做了大量的预研工作,但生物体内的物理化学环境远比实验室复杂的多,真正攻克这些难题还需要巨大的投入和踏实的探索。
虽然这些困难看起来千头万绪,但任何一个变革性的技术都是经过了数十年的积累和探索,才有后来的厚积薄发。
例如,把医生送进体内,和把人类送上月球的阿波罗计划一样,有很多相似之处:两者都是复杂、系统但有巨大的意义的工程;两者都涉及许多步骤,并且都需要考虑复杂、陌生的环境;两者都涉及机器高效的驱动,以及远程、精准的控制。
如果60年前的人类有办法取得如此伟大的成就,我坚信 60年后的我们,以及青出于蓝的后辈科学家、工程师们,一定可以做出更大更辉煌的事业,攻克纳米机器人医生这个纳米技术的世纪难题。






 扫码下载APP
扫码下载APP

 科普中国APP
科普中国APP
 科普中国
科普中国
 科普中国
科普中国